
【题目】配合物乙二胺四乙酸铁钠( SaFeY)可溶于水,常见于铁强化盐中,回答下列问题:
实验1 制备乙二胺四乙酸铁钠晶体
实验原理:2Fe(OH)3+Na2CO3+2H4Y===2[NaFeY·3H2O]+CO2↑+H2O
实验步骤:①称取2.7 g FeCl3·6H2O于烧杯中溶解,分批次加入适量浓氨水,搅拌,过滤,洗涤,干燥。②将Fe(OH)3、乙二胺四乙酸(H4Y)、H2O加入三颈烧瓶(装置如下图),搅拌,80℃水浴反应1h,用Na2CO3溶液调节pH,经过一系列操作,过滤洗涤,晾干得到产品。

(1)“步骤①”为避免Fe(OH)3沉淀中裹入过多杂质,采取的措施有___________。
(2)判断“步骤①”中沉淀是否洗涤干净的操作为___________。
(3)若滴液漏斗替换为分液漏斗,实验中Na2CO3溶液将无法顺利滴下,其原因为___________。
(4)“步骤②”中的“一系列操作”为___________(填标号),若将溶液直接蒸干,会造成___________。
A.蒸发浓缩,趁热结晶
B.蒸发浓缩至溶液表面出现晶膜,停止加热
C蒸发浓缩至大量晶体析出,停止加热
实验2市售铁强化盐中铁含量测定
已知:①铁强化盐含有NaCl、KIO3 、NaFeY,其中n(KIO3)︰n( NaFeY)=1︰50
②I2+2S2O32-===2I-+ S4O62-
称取mg样品,加稀硫酸溶解后配成100mL溶液。取出10mL,加入稍过量的KI溶液,充分反应后,滴入淀粉溶液,用cmol·L-1Na2S2O3标准液滴定,重复操作2~3次,消耗Na2S2O3标准液平均值为VmL。
(5)I-除了与Fe3+反应外,还可发生的反应的离子方程式为___________。
(6)滴定终点的现象为___________填颜色变化)。
(7)样品中铁元素的质量分数为___________。
【答案】分批次加入浓氨水、搅拌 取最后一次洗涤液于试管中,加入AgNO3溶液 反应需要加热且产生气体,使得三颈烧瓶内压强增大 B NaFeY3H2O分解、晶体飞溅 5I-+IO3-+6H+=3I2+3H2O 蓝色褪去 cV/2m
【解析】
根据实验原理及仪器构造分析解答;根据滴定原理计算铁元素的质量分数;根据氧化还原反应原理书写化学方程式。
(1)根据实验操作原理分析知采取的措施有分批次加入浓氨水、搅拌,
故答案为:分批次加入浓氨水、搅拌;
(2)可以通过检验是否存在Cl-,操作为取最后一次洗涤液于试管中,加入AgNO3溶液,
故答案为:取最后一次洗涤液于试管中,加入AgNO3溶液;
(3)根据仪器构造分析知其原因为反应需要加热且产生气体,使得三颈烧瓶内压强增大,故答案为:反应需要加热且产生气体,使得三颈烧瓶内压强增大;
(4)蒸发的正确操作是蒸发浓缩至溶液表面出现晶膜,停止加热;若将溶液蒸干,会引起NaFeY3H2O分解、晶体飞溅,
故答案为:B;NaFeY3H2O分解、晶体飞溅;
(5)IO3-也有氧化性,可以与I-发生反应,离子方程式为5I-+IO3-+6H+=3I2+3H2O,
故答案为:5I-+IO3-+6H+=3I2+3H2O;
(6)滴定终点的现象为蓝色褪去,
故答案:蓝色褪去;
(7) 2NaFeY~I2~2S2O32-
m(Fe)=cmol·L-1×V×10-3L×![]() ×56g/mol=56cV/100,
×56g/mol=56cV/100,
则样品中铁元素的质量分数为![]() ×100%≈cV/2m,
×100%≈cV/2m,
故答案为:cV/2m。


 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案科目:高中化学 来源: 题型:
【题目】如图是某课外小组制取乙炔并测定乙炔的某些性质的实验.

(1)写出实验室制取乙炔的化学方程式: ______.
(2)实验室制取乙炔时,分液漏斗中的液体 a通常是 ______.
(3)B溶液的作用是 ______.
(4)装置D中的现象是: ______.
(5)乙炔能否使溴的的四氯化碳溶液褪色?______(“能”或“不能”),若能写出完全反应原理_______________
(6)工业上常用乙炔、氯化氢等物质作原料来合成聚氯乙烯,请写出相关方程式 _______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,pH=11的氨水和NaOH溶液分别加水稀释100倍,溶液的pH随溶液体积变化的曲线如下图所示。据图判断错误的是( )

A. a的数值一定大于9
B. Ⅱ为氨水稀释时溶液的pH变化曲线
C. 稀释后氨水中水的电离程度比NaOH溶液中水的电离程度大
D. 完全中和相同体积的两溶液时,消耗相同浓度的稀硫酸的体积:V(NaOH)<V(氨水)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳是化合物种类最多的元素,其单质及化合物是人类生产生活的主要能源物质。请回答下列问题:

(1)有机物M经过太阳光照可转化成N,转化过程如下:ΔH=+88.6 kJ·mol-1。则M、N相比,较稳定的是_______________。
(2)已知CH3OH(l)的燃烧热为238.6 kJ·mol-1,CH3OH(l)+![]() O2(g)=CO2(g)+2H2(g) ΔH=-akJ·mol-1,则a____________238.6(填“>”、“<”或“=”)。
O2(g)=CO2(g)+2H2(g) ΔH=-akJ·mol-1,则a____________238.6(填“>”、“<”或“=”)。
(3)使Cl2和H2O(g)通过灼热的炭层,生成HCl和CO2,当有1 mol Cl2参与反应时释放出145 kJ热量,写出该反应的热化学方程式:____________________。
(4)火箭和导弹表面的薄层是耐高温物质。将石墨、铝粉和二氧化钛按一定比例混合在高温下煅烧,所得物质可作耐高温材料,反应的热化学方程式如下:4Al(s)+3TiO2(s)+3C(s)=2Al2O3(s)+3TiC(s) ΔH=-1176 kJ·mol-1。则反应过程中,每转移1 mol e-放出的热量为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图中A是制取溴苯的实验装置,B、C是改进后的装置,请仔细分析,对比三个装置,回答以下问题:

(1)写出三个装置中所共同发生的两个反应的化学方程式:____;_____。
(2)装置A和C均采用了长玻璃导管,其作用是____,_____。
(3)在按装置B、C装好仪器及药品后要使反应开始,应对装置B进行的操作是____;应对装置C进行的操作是____。
(4)装置B、C较好地解决了A中加装药品和使装置及时密封的矛盾,方便了操作。A装置中这一问题在实验中造成的后果是____。
(5)B中采用了洗气瓶吸收装置,其作用是___,反应后洗气瓶中可能出现的现象是______。
(6)B装置也存在两个明显的缺点,使实验的效果不好或不能正常进行。这两个缺点是____,____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】糖类、油脂、蛋白质是人类生活的基本营养物质,下列叙述不正确的是
A.葡萄糖是单糖B.淀粉是糖类物质,它遇碘化钾迅速变蓝
C.蛋白质烧焦时可产生特殊气味D.油脂在碱性条件下水解可以制肥皂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据图,下列判断中正确的是

A. 电路中电子的流动方向:adCuSO4(aq) cb
B. 该原电池原理:Zn+CuSO4 ═ ZnSO4+Cu
C. c电极质量减少量等于d电极质量增加量
D. d电极反应:Cu2++2e = Cu,反应后CuSO4溶液浓度下降
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】G是药物合成中的一种重要中间体,下面是G的一种合成路线:
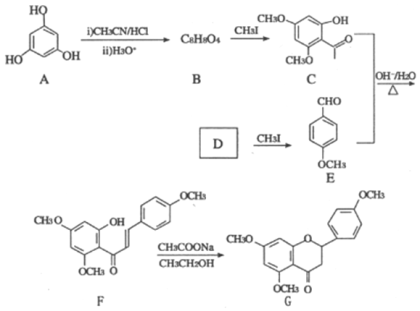
回答下列问题:
(1)B的结构简式为__________,其中所含官能团的名称为__________;B生成C的反应类型为__________。
(2)D的名称是__________。
(3)由C和E合成F的化学方程式为________________________________________。
(4)D的同分异构体中,能发生银镜反应且分子结构中含苯环的还有__________种,其中核磁共振氢谱上有6组峰,峰面积之比为1∶1∶1∶1∶1∶1的同分异构体的结构简式为______________________ (一种即可)。
(5)参照上述合成路线,以CH3CH2Cl为原料(其他试剂任选),设计制备巴豆醛(CH3CH=CH
CHO)的合成路线。_______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤的液化可以合成甲醇。下列有关说法正确的是
①“气化”:C(s)+2H2O(g)===CO2(g)+2H2(g)ΔH1=+90.1kJ·mol—1
②催化液化I:CO2(g)+3H2(g)===CH3OH(g)+H2O(g)△H2=-49.0kJ·mol—1
③催化液化Ⅱ:CO2(g)+2H2(g)===CH3OH(g)+![]() O2(g)△H3=akJ·mol
O2(g)△H3=akJ·mol
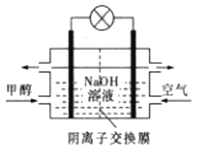
A. 催化液化I的反应在高温下更容易自发进行
B. C(s)+H2O(g)+H2(g)==CH3OH(g)△H=+41.1kJ·mol—1
C. △H2>△H3
D. 如图所示为甲醇燃料电池的工作原理示意图,负极的电极反应为CH3OH-6e—+6OH—=CO2↑+5H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com