
【题目】某混合物A,含有Al2(SO4)3、Al2O3和Fe2O3 , 在一定条件下可实现如图所示的物质之间的变化: 
据此回答下列问题:
(1)Ⅰ、Ⅱ、Ⅲ、Ⅳ四步中对于溶液和沉淀的分离采取的方法是 .
(2)根据上述框图反应关系,写出下列B、E所含物质的化学式 B;E .
(3)写出②、③两个反应方程式 ②;③ .
【答案】
(1)过滤
(2)Al2O3;(NH4)2SO4
(3)Al2(SO4)3+6NH3?H2O=2Al(OH)3↓+3(NH4)2SO4;NaAlO2+HCl+H2O=NaCl+Al(OH)3↓
【解析】解:Al2(SO4)3溶于水,Al2O3和Fe2O3均不溶于水,混合物A加水溶解后,溶液中是Al2(SO4)3 , 沉淀C为Al2O3和Fe2O3;由转化关系图可知,向沉淀C中加NaOH溶液,Fe2O3不反应,沉淀D为Fe2O3 , Al2O3可与NaOH溶液反应生成NaAlO2 , 向NaAlO2溶液中通入CO2可得Al(OH)3沉淀,Al(OH)3受热分解生成固体B为Al2O3; 向溶液中加过量氨水,溶液与过量氨水反应,Al3+被沉淀,得到氢氧化铝沉淀,溶液中E为(NH4)2SO4 , 经过蒸发、结晶,得到(NH4)2SO4 , (1)溶液和沉淀的分离利用过滤,所以答案是:过滤;(2)由上述分析可知B为Al2O3 , D为(NH4)2SO4 , 所以答案是:Al2O3;(NH4)2SO4;(3)反应②为Al2(SO4)3+6 NH3 . H2O=3(NH4)2SO4+2Al(OH)3↓,反应③为NaAlO2+HCl+H2O=NaCl+Al(OH)3↓,所以答案是:Al2(SO4)3+6NH3H2O=2Al(OH)3↓+3(NH4)2SO4;NaAlO2+HCl+H2O=NaCl+Al(OH)3↓.


 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案科目:高中化学 来源: 题型:
【题目】选用适当的试剂和除杂方法除去下列各物质中的杂质(括号中为杂质),将所选试剂和操作的名称填写在表格中.
序号 | 物质 | 试剂 | 除杂方法 |
① | 甲烷(C2H4) | ||
② | 硝基苯(混合酸) | ||
③ | KNO3(NaCl) |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠常用作食品防腐剂。现用下图所示仪器(夹持装置已省略)及药品。探究亚硝酸钠与硫酸的反应及生成气体产物的成分。巳知气体液化的温度:NO2:21℃;NO:-152 ℃
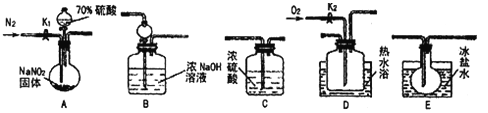
回答下列问题:
(1)为了检验装置A中生成的气体产物,仪器的连接顺序为(按从左到右连接): A→C→___→____→______。
(2)组装好仪器后,接下来进行的操作是____;实验开始时通入N2的作用是______.
(3)关闭弹赞夹K1,打开分液漏斗活塞,滴入70%硫酸后,A中产生红棕色气体。确认A中产生的气体中含有NO,依据的现象是__________;装置E的作用是__________。
(4)根据上述实验,写出该反应的化学方程式:__________。
如果没有装置C,对验证结论造成的影响是__________。
(5)实验结束后还需通入N2的作用是_______;如果向D中通入过量O2,则装置B中发生反应的离子方程式为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某无色溶液中缓慢地滴入NaOH溶液直至过量,产生沉淀的质量与加入的NaOH溶液体积的关系如图所示,由此确定,原溶液中含有的阳离子是( ) 
A.Mg2+、Al3+、Fe2+
B.H+、Mg2+、Al3+
C.H+、Ba2+、Al3+
D.只有Mg2+、Al3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对氨基苯磺酸是制取染料和一些药物的重要中间体,可由苯胺磺化得到:
![]() +H2SO4
+H2SO4![]()
![]() +H2O
+H2O
实验室可利用如图所示装置合成对氨基苯磺酸。实验步骤如下:

①在一个250 mL三颈烧瓶中加入10 mL苯胺及几粒沸石,将三颈烧瓶放入冷水中冷却,小心地加入18 mL浓硫酸。
②将三颈烧瓶置于油浴中缓慢加热至170~180 ℃,维持此温度2~2.5 h。
③将反应液冷却至约50 ℃后,倒入盛有100 mL冷水的烧杯中,玻璃棒不断搅拌,促使晶体析出,抽滤,用少量冷水洗涤,得到的晶体是对氨基苯磺酸粗产品。
④将粗产品用沸水溶解,冷却结晶(若溶液颜色过深,可用活性炭脱色),抽滤,收集产品,晾干(100 mL水在20 ℃时可溶解对氨基苯磺酸1.08 g,在100 ℃时可溶解6.67 g)。
(1)装置中冷凝管的作用是____________________。
(2)步骤②中采用油浴加热,用油浴加热的优点是____________________。
(3)步骤③用少量冷水洗涤晶体的好处是____________________。
(4)步骤③和④均进行抽滤,在抽滤后停止抽滤时,应注意先__________________,然后__________________,以防倒吸。
(5)步骤④中有时需要将“粗产品用沸水溶解,冷却结晶,抽滤”的操作进行多次,其目的是____________________________。每次抽滤后均应将母液收集并适当处理,其目的是____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】主族元素在周期表中的位置取决于该元素原子的( )。
A. 相对原子质量和核外电子数
B. 电子层数和最外层电子数
C. 相对原子质量和最外层电子数
D. 电子层数和次外层电子数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】饮用水中的NO3﹣对人类健康会产生危害,为了降低饮用水中NO3﹣的浓度,某饮用水研究人员提出,在碱性条件下用铝粉将NO3﹣还原为N2 , 其化学方程式为Al+NaNO3+NaOH﹣NaAlO2+N2↑+H2O (未配平).请回答下列问题:
(1)上述反应中,元素的化合价升高,则该元素的原子(填“得到”或“失去”)电子;而元素的化合价降低,则该元素的原子被(填“氧化”或“还原”).
(2)配平上述反应:Al+NaNO3+NaOH=NaAlO2+N2↑+H2O
(3)用“双线桥法”表示反应中电子转移的方向和数目:
(4)上述反应中若标准状况下产生11.2L气体物质,则转移电子的数目为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的化学方程式(或离子方程式)错误的是
A. 乙醛与银氨溶液反应 CH3CHO+2[Ag(NH3)2]OH![]() CH3COONH4+2Ag↓+3NH3+H2O
CH3COONH4+2Ag↓+3NH3+H2O
B. 向Na2CO3溶液中加入过量醋酸溶液:CO32-+2H+=CO2↑+H2O
C. 苯酚与氢氧化钠溶液反应 C6H5OH+OH—→ C6H5O—+H2O
D. 用铁棒作阳极、碳棒作阴极电解饱和氯化钠溶液:2C1-+2H2O![]() H2↑+Cl2↑+2OH—
H2↑+Cl2↑+2OH—
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种驱动潜艇的液氨-液氧燃料电池原理示意如图,下列有关该电池说法正确的是( )

A. 电流由电极A经外电路流向电极B
B. 电池工作时,OH-向电极B移动
C. 该电池工作时,每消耗22.4L NH3转移3mol电子
D. 电极A上发生的电极反应为:2NH3-6e-+ 6OH-=N2 + 6H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com