
【题目】饮用水中的NO3﹣对人类健康会产生危害,为了降低饮用水中NO3﹣的浓度,某饮用水研究人员提出,在碱性条件下用铝粉将NO3﹣还原为N2 , 其化学方程式为Al+NaNO3+NaOH﹣NaAlO2+N2↑+H2O (未配平).请回答下列问题:
(1)上述反应中,元素的化合价升高,则该元素的原子(填“得到”或“失去”)电子;而元素的化合价降低,则该元素的原子被(填“氧化”或“还原”).
(2)配平上述反应:Al+NaNO3+NaOH=NaAlO2+N2↑+H2O
(3)用“双线桥法”表示反应中电子转移的方向和数目:
(4)上述反应中若标准状况下产生11.2L气体物质,则转移电子的数目为 .
【答案】
(1)Al;失去;N;还原
(2)10;6;4;10;3;2
(3)
(4)3.01×1024或者5NA
【解析】解:(1)Al元素的化合价升高,失去电子,Al被氧化作还原剂,NaNO3中N元素化合价降低得电子,被还原,所以答案是:Al;失去; N;还原;(2)反应中Al→AlO2﹣ , Al元素化合价由0价升高为+3价,共升高3价,NO3﹣→N2↑,氮元素化合价由+5价降低为0价,共降低10价,化合价升降最小公倍数为30,故Al的系数为10,N2系数为3,由氮元素守恒可知系数为6,由Al元素守恒可知系数为10,由电荷守恒可知OH﹣系数为4,由H元素守恒可知H2O前面的系数为2,方程式为10Al+6NaNO3+4NaOH=10NaAlO2+3N2↑+2H2O,所以答案是:10;6;4;10;3;2;(3)该反应中只有Al元素失电子化合价升高,Al元素化合价由0价变为+3价,所以10molAl完全反应转移电子的物质的量为30mol,则转移电子数为30NA;该反应中Al元素化合价由0价变为+3价,N元素化合价由+5价变为0价,根据方程式知,该反应中转移电子数是30,用双线桥表示电子转移方向和数目为  ,所以答案是:
,所以答案是:  ;(4)产生11.2L气体,物质的量为0.5mol,则转移的电子的物质的量为0.5mol×2×(5﹣0)=5mol,数目为3.01×1024或者5NA , 所以答案是:3.01×1024或者5NA
;(4)产生11.2L气体,物质的量为0.5mol,则转移的电子的物质的量为0.5mol×2×(5﹣0)=5mol,数目为3.01×1024或者5NA , 所以答案是:3.01×1024或者5NA


科目:高中化学 来源: 题型:
【题目】下列关于氮及其化合物说法,不正确的是
A.人体中极少量的NO会促进血管扩张,防止血管栓塞
B.光化学烟雾即为含有二氧化氮的有毒烟雾
C.氨水可作化肥
D.工业硝酸常因溶有少量NO2而略显黄色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“人文奥运”的一个重要体现是坚决反对运动员服用兴奋剂。某种兴奋剂的结构简式如图所示,下列有关该物质的说法正确的是( )

A. 遇FeCl3溶液显紫色,因为该物质与苯酚属于同系物
B. 该分子中的所有碳原子有可能共平面
C. 1 mol该物质分别与浓溴水和H2反应时,最多消耗Br2和H2分别为4 mol、6 mol
D. 滴入KMnO4酸性溶液,观察到紫色褪去,能证明结构中存在碳碳双键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某混合物A,含有Al2(SO4)3、Al2O3和Fe2O3 , 在一定条件下可实现如图所示的物质之间的变化: 
据此回答下列问题:
(1)Ⅰ、Ⅱ、Ⅲ、Ⅳ四步中对于溶液和沉淀的分离采取的方法是 .
(2)根据上述框图反应关系,写出下列B、E所含物质的化学式 B;E .
(3)写出②、③两个反应方程式 ②;③ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素X、Y、Z、M、N均为原子序数依次增大的短周期主族元素;R在地壳金属元素中的含量仅次于Z。已知Y原子最外层电子数与核外电子总数之比为3:4,M原子的最外层电子数与次外层电子数之比为3:4;N-、Z3+、X+离子半径逐渐减小;化合物XN常温下为气体,请回答下列问题:
(1)R在元素周期表中的位置是____________;Z3+的离子结构示意图是____________。
(2)写出X、Y、N按原子个数之比1:1:1:形成的化合物的电子式__________;M和N气态氢化物的稳定性大小比较为________(用化学式和“>”“<”或“=”表示)。
(3)X与Y可分别形成10电子和18电子的分子,写出该18电子分子转化成10电子分子的化学方程式__________________________________.
(4)Z元素的单质能与Y和R形成的化合物在一定条件下发生反应,同时放出大量的热,其反应的化学方程式为_____________________________。
(5)下图表示由上述元素中的某两种元素组成的气体分子在一定条件下的密闭容器中充分反应前后的转化关系,在该转化关系中还原剂是__________(填化学式),示意图中转移电子的数目为______。


(6)由X、Y、M三种元素组成的离子,在水溶液中与H+和OH-均不能大量共存,还能和氯水反应,写出其与新制氯水反应的离子方程式_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有V L 0.5mol/L的盐酸,欲将其浓度扩大一倍,以下方法中最宜采用的是( )
A.加热浓缩到原来体积的一半
B.加入0.05mol/L的盐酸0.125V L
C.加入10mol/L的盐酸0.1V L,再稀释至1.5 V L
D.标况下通入11.2L氯化氢气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为A、B、C、D、E之间的相互转换关系A为一种气态单质,D是一种红棕色气体。下列说法正确的是
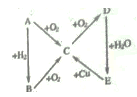
A. C 物质和O2必须在催化剂表面才能反应生成D
B. Cu 和E 溶液反应体现了E 的强氧化性和酸性
C. 可用NaOH 溶液除去混在D物质中的少量B 物质
D. B 生成C 的反应中,氧化剂与还原剂之比为4: 5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图表示某种有机物的结构,关于它的性质叙述中正确的是

A. 1mol该有机物在一定条件下,能与7molH2发生加成反应
B. 不能与FeCl3溶液作用发生显色反应
C. 能与NaHCO3反应放出气体
D. 1mol该有机物在一定条件下,能与8molNaOH反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜和镁的合金4.6g完全溶于浓硝酸,若反应中硝酸被还原只产生4480mL的NO2气体和336mL的N2O4气体(都已折算到标准状况),在反应后的溶液中,加入足量的NaOH溶液,生成沉淀的质量为多少克?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com