
【题目】硫酸铵可用作肥料,也可用于纺织、皮革、医药等方面。某化学兴趣小组对硫酸铵的一些性质进行探究。回答下列问题:
(1)在试管中加入少量硫酸铵样品,加水溶解,滴加NaOH溶液。将湿润的红色石蕊试纸放在试管口,试纸颜色无明显变化。再将试管加热,试纸很快变蓝。由此可知:______________________________________、_________________________________。
(2)从废铁屑中回收铁屑,用碱溶液洗净之后,再用过量硫酸溶解。然后加入稍过量硫酸铵饱和溶液。在小火下蒸发溶剂直到晶膜出现,停火利用余热蒸发溶剂。过滤后用少量乙醇洗涤,得到硫酸亚铁铵晶体。
①碱溶液洗涤的目的是__________________________________。
②硫酸过量的原因是___________________________________。
(3)硫酸铵高温下完全分解生成氨气和其他几种气体(含硫产物只有一种)。为探究硫酸铵的其他分解产物,通过下列装置进行实验,通入分解产物一段时间后,再点燃装置E中的酒精灯并开始用装置F收集气体。实验中观察到E中无明显现象,F中排水收集的气体能使燃着的木条熄灭,经测定其相对分子质量为28。

①装置A、B中的溶液分别是______(填标号)。B中可观察到的现象是_____________________。
a.NaOH溶液 b.硫酸溶液 c.BaCl2溶液 d.品红溶液
②装置E的作用是__________________________________。
③写出(NH4)2SO4高温分解的化学方程式:________________________________________。
【答案】NH4+与OH-反应生成的NH3·H2O在加热条件下分解生成NH3, NH3溶于水呈碱性除去铁屑表面的油污抑制Fe2+水解b、d溶液红色变浅(或褪色)验证硫酸铵分解产物中是否存在氧气3(NH4)2SO4![]() 4NH3↑+N2↑+3SO2↑+6H2O↑
4NH3↑+N2↑+3SO2↑+6H2O↑
【解析】
(1)在试管中加入少量硫酸铵样品,加水溶解,滴加NaOH溶液。将湿润的红色石蕊试纸放在试管口,试纸颜色无明显变化,再将试管加热,试纸很快变蓝,说明硫酸铵溶液和NaOH溶液反应生成一水合氨,一水合氨在加热条件下分解生成NH3, NH3溶于水呈碱性;
(2)碱溶液可以洗涤铁屑表面的油污;硫酸亚铁铵溶液因Fe2+、NH4+水解显酸性,过量的硫酸可以抑制Fe2+、NH4+水解;
(3)由题意,F中排水收集的气体能使燃着的木条熄灭,经测定其相对分子质量为28可知F中排水收集的气体是氮气,硫酸铵高温下完全分解生成氮气,说明氮元素化合价升高,则硫酸根中的硫元素化合价一定降低,E中无明显现象说明混合气体中一定没有氧气,说明混合气体中一定存在二氧化硫,则硫酸铵的分解产物为氨气、氮气、二氧化硫和水,反应的化学方程式为:3(NH4)2SO4![]() 4NH3↑+N2↑+3SO2↑+6H2O↑;探究硫酸铵的其他分解产物时,一定要排除氨气对二氧化硫检验的干扰,A中硫酸溶液吸收氨气,排除氨气对二氧化硫检验的干扰,B中品红溶液检验二氧化硫。
4NH3↑+N2↑+3SO2↑+6H2O↑;探究硫酸铵的其他分解产物时,一定要排除氨气对二氧化硫检验的干扰,A中硫酸溶液吸收氨气,排除氨气对二氧化硫检验的干扰,B中品红溶液检验二氧化硫。


 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案科目:高中化学 来源: 题型:
【题目】中国传统文化对人类文明贡献巨大。下列两篇古代文献中都涉及到了![]() 。文献①:《开宝本草》记载:“
。文献①:《开宝本草》记载:“![]() 所在山泽,冬月地上有霜,扫取以水淋汁后,乃煎炼而成”,文献②《本草纲目》“火药乃焰硝
所在山泽,冬月地上有霜,扫取以水淋汁后,乃煎炼而成”,文献②《本草纲目》“火药乃焰硝![]() 、硫黄、山本炭所合,以为烽燧铜诸药者”。下列对其解释不合理的是
、硫黄、山本炭所合,以为烽燧铜诸药者”。下列对其解释不合理的是
A. 文献①中提取![]() ,利用了溶解、蒸发、结晶的实验过程
,利用了溶解、蒸发、结晶的实验过程
B. 文献②中使用火药的产物不会污染环境
C. 用文献①中方法制取![]() 是因为
是因为![]() 的溶解度受温度影响较大
的溶解度受温度影响较大
D. 文献②中火药的作用体现了硝酸钾的氧化性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知![]() 为
为![]() 和
和![]() 的混合物,且知氧化性顺序:
的混合物,且知氧化性顺序:![]() ,取
,取![]() 样品进行如下图所示的实验:
样品进行如下图所示的实验:

(1)写出③步可能发生反应的3个离子方程式为________________________、________________________、________________________。
(2)若溶液E中只有一种金属离子,则一定是______;若D固体是纯净物,该固体是______。(填化学式)
(3)向溶液A中加入![]() 粉,若会反应,则写出反应的离子方程式,若不会反应,则填“不能”在横线上__________________________________________。
粉,若会反应,则写出反应的离子方程式,若不会反应,则填“不能”在横线上__________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒容密闭容器中通入A、B两种气体,在一定条件下发生反应:
2A(g)+B(g)![]() 2C(g) ΔH>0。
2C(g) ΔH>0。
达到平衡后,改变一个条件(x),下列量(y)一定符合图中曲线的是( )
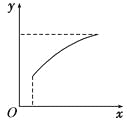
选项 | x | y |
A | 再通入A | B的转化率 |
B | 加入催化剂 | A的体积分数 |
C | 压强 | 混合气体的总物质的量 |
D | 温度 | 混合气体的总物质的量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铬铁矿主要成分为FeO、Cr2O3,含有SiO2、Al2O3等杂质。工业上用铬铁矿制备红矾钠晶体(Na2Cr2O7)的流程如图所示:

(1)步骤①的主要反应为FeO·Cr2O3+O2+NaOH![]() Na2CrO4+NaFeO2+H2O,该反应配平后FeO·Cr2O3与O2的系数比为___________。该步骤是在坩埚中进行煅烧,可用此坩埚材料的是______________(填标号)。
Na2CrO4+NaFeO2+H2O,该反应配平后FeO·Cr2O3与O2的系数比为___________。该步骤是在坩埚中进行煅烧,可用此坩埚材料的是______________(填标号)。
A.铁 B.氧化铝 C.石英 D.陶瓷
(2)步聚①煅烧反应极慢,需要升温至NaOH呈熔融状态,反应速率才加快,其原因是____________________________________________________。
(3)步骤②中NaFeO2会强烈水解生成氢氧化铁沉淀,反应的化学方程式为________________。
(4)将五份滤液1分别在130℃蒸发1小时,各自冷却到不同温度下结晶,保温过滤,所得实验数据如下表。根据数据分析,步骤③的最佳结晶温度为___________℃。
结晶温度/℃ | Na2CrO4粗晶中各物质含量/% | |||
Na2CrO4 4H2O | NaOH | NaAlO2 | Na2SiO3 | |
30 | 52.45 | 29.79 | 8.69 | 12.21 |
40 | 68.81 | 20. 49 | 8.46 | 10.84 |
50 | 60.26 | 27. 96 | 10.36 | 9.32 |
60 | 50.74 | 29.66 | 10.40 | 12.25 |
70 | 46.77 | 33.06 | 8.10 | 6.48 |
(5)步骤④中滤渣3的成分是_____________(写化学式)。
(6)若该流程中铬元素完全转化为红矾钠晶体,则该铬铁矿中铬元素的质量分数为____________(用含m1、m2的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在一容积为1L的密闭容器中,加入0.4 mol的N2和1.2 mol的H2,在一定条件下发生如下反应:N2(B)+3H2(g)![]() 2NH3(g) △H<0,5min 时达到平衡,反应中NH3的物质的量浓度的变化情况如图所示:
2NH3(g) △H<0,5min 时达到平衡,反应中NH3的物质的量浓度的变化情况如图所示:

请回答下列问题:
(1) 根据如图,计算从反应开始到平衡时,平均反应速率v(N2)=_________。
(2) 该反应的化学平衡常数表达式为__________________。
(3) 反应达到平衡后,第5min末保持其他条件不变,若改变反应温度,则NH3的物质的量浓度不可能为_________(填序号)。
A.0.80mol·L-1 B.0.25mol·L-1 C.0.20mol·L-1 D.0.08mol·L-1
(4) 反应达到平衡后,第5 min末保持其他条件不变,若只把容器的体积缩小一半,平衡移动_________(填“向右”、“向左”或“不”,化学平衡常数_________( 填“增大”、“减少”或“不变”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钙是一种温和的氧化剂,常温下为白色的固体,无臭无味,能潮解,难溶于水,可与水缓慢反应;不溶于醇类、乙醚等,易与酸反应,常用作杀菌剂、防腐剂等。某实验小组拟选用如下装置(部分固定装置略)制备过氧化钙。


(1)请选择必要的装置,按气流方向连接顺序为_____________(填仪器接口的字母编号,装置可重复使用)。
(2)根据完整的实验装置进行实验,实验步骤如下:①检验装置的气密性后,装入药品;②打开分液漏斗活塞通入一段时间气体,加热药品;③反应结束后,_______________(填操作);④拆除装置,取出产物。
(3)一小组同学利用CaCl2在碱性条件下与H2O2反应制得。制备CaO2的实验方案和装置示意图如下:


①三颈烧瓶中发生的主要反应的化学方程式为___________________________________;
②支管B的作用是_________________________;
③步骤③中洗涤CaO2·8H2O的液体X的最佳选择是____________;
A.无水乙醇 B.浓盐酸 C.水 D.CaCl2溶液
④该反应常用冰水浴控制温度在0℃左右,其可能的原因该反应是放热反应,温度低有利于提高CaO2·8H2O产率;________________________________________。
(4)测定产品中CaO2含量的实验步骤如下:
步骤一:准确称取a g产品于有塞锥形瓶中,加入适量蒸馏水和过量的b g KI晶体,再滴入少量2 mol·L-1的硫酸,充分反应。
步骤二:向上述锥形瓶中加入几滴________(作指示剂)。
步骤三:逐滴加入浓度为c mol·L-1的Na2S2O3溶液至反应完全,滴定至终点,记录数据,再重复上述操作2 次,得出三次平均消耗Na2S2O3溶液的体积为V mL。
CaO2的质量分数为________(用字母表示)。(已知:I2 + 2S2O![]() ===2I-+ S4O
===2I-+ S4O![]() )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某干燥粉末可能由Na2O、Na2O2、Na2CO3、NaHCO3、NaCl中的一种或几种组成。将该粉末与足量的盐酸反应有气体X逸出,X通过足量的NaOH溶液后体积缩小(同温、同压下测定),且有气体剩余。若将原来混合粉末在空气中用酒精灯加热,也有气体放出,且剩余固体的质量大于原混合粉末的质量。下列判断正确的是
①粉末中一定有Na2O、Na2O2、和NaHCO3
②粉末中一定不含有Na2CO3和NaCl
③粉末中一定不含有Na2O2和NaCl
④无法肯定粉末中是否含有Na2CO3和NaCl
A. ①② B. ②③ C. ③④ D. ①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于很多人来说,喝茶是人生的一大乐事,茶叶中含有少量的咖啡因。咖啡因具有扩张血管、刺激心脑等作用,在100 ℃时失去结晶水并开始升华,120 ℃时升华相当显著,178 ℃时升华很快。其结构简式如图所示。

实验室可通过下列简单方法从茶叶中提取咖啡因:

(1)咖啡因的分子式为___________。
(2)步骤1浸泡茶叶所用的溶剂最好为___________(填序号)。
A.水 B.乙醇 C.石油醚
(3)步骤1、步骤4所进行的操作或方法分别是______、______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com