
【题目】对于很多人来说,喝茶是人生的一大乐事,茶叶中含有少量的咖啡因。咖啡因具有扩张血管、刺激心脑等作用,在100 ℃时失去结晶水并开始升华,120 ℃时升华相当显著,178 ℃时升华很快。其结构简式如图所示。

实验室可通过下列简单方法从茶叶中提取咖啡因:

(1)咖啡因的分子式为___________。
(2)步骤1浸泡茶叶所用的溶剂最好为___________(填序号)。
A.水 B.乙醇 C.石油醚
(3)步骤1、步骤4所进行的操作或方法分别是______、______。
科目:高中化学 来源: 题型:
【题目】硫酸铵可用作肥料,也可用于纺织、皮革、医药等方面。某化学兴趣小组对硫酸铵的一些性质进行探究。回答下列问题:
(1)在试管中加入少量硫酸铵样品,加水溶解,滴加NaOH溶液。将湿润的红色石蕊试纸放在试管口,试纸颜色无明显变化。再将试管加热,试纸很快变蓝。由此可知:______________________________________、_________________________________。
(2)从废铁屑中回收铁屑,用碱溶液洗净之后,再用过量硫酸溶解。然后加入稍过量硫酸铵饱和溶液。在小火下蒸发溶剂直到晶膜出现,停火利用余热蒸发溶剂。过滤后用少量乙醇洗涤,得到硫酸亚铁铵晶体。
①碱溶液洗涤的目的是__________________________________。
②硫酸过量的原因是___________________________________。
(3)硫酸铵高温下完全分解生成氨气和其他几种气体(含硫产物只有一种)。为探究硫酸铵的其他分解产物,通过下列装置进行实验,通入分解产物一段时间后,再点燃装置E中的酒精灯并开始用装置F收集气体。实验中观察到E中无明显现象,F中排水收集的气体能使燃着的木条熄灭,经测定其相对分子质量为28。

①装置A、B中的溶液分别是______(填标号)。B中可观察到的现象是_____________________。
a.NaOH溶液 b.硫酸溶液 c.BaCl2溶液 d.品红溶液
②装置E的作用是__________________________________。
③写出(NH4)2SO4高温分解的化学方程式:________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】认真观察下列有机化合物,回答下列问题:

(1)D中含有的官能团有_________(填写名称,下同),E中含有的官能团有_________________。
(2)下列说法中,错误的是_______。
A.A物质属于酚类 B.B物质分子中含有羧基、醇羟基和酚羟基三种官能团
C.C物质的分子式为C8H8O4 D.F分子中只含有酯基一种官能团
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物只含有C、H、O三种元素,其分子模型如图所示,分子中共有12个原子(图中球与球之间的连线代表单键、双键等化学键)。

(1)该有机物的结构简式为___________。
(2)该有机物中所含官能团的名称为___________。
(3)下列物质中,与该有机物互为同系物的是___________(填序号,下同),互为同分异构体的是___________。
①CH3CH=CHCOOH ②CH2=CHCOOCH3
③CH3CH2CH=CHCOOH ④(CH3)2CHCOOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z、W的原子序数依次增大,X、W同主族;Y、Z同周期;X、Y、Z三种元素形成一种化合物M,25 ℃时,0.1 molL-1的M溶液中 =1.0×10-12。下列说法正确的是
=1.0×10-12。下列说法正确的是
A. 简单离子半径:Y<Z<W
B. X分別与Z、W形成的化合物中,所含化学键类型相同
C. X、Y形成的最简单化合物的电子式为![]()
D. Z分別与X、W均可形成具有漂白性的化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)2017年中科院某研究团队通过设计一种新型Na-Fe3O4/HZSM-5多功能复合催化剂,成功实现了CO2直接加氢制取辛烷值汽油,该研究成果被评价为“CO2催化转化领域的突破性进展”。
已知:H2(g)+1/2O2(g)=H2O(l) ΔH1 = -aKJ/mol
C8H18(1)+25/2O2(g)=8CO2(g)+9H2O(1) ΔH2= -bKJ/mol
试写出25℃、101kPa条件下,CO2与H2反应生成汽油(以C8H18表示)的热化学方程式_________________________________。
(2)利用CO2及H2为原料,在合适的催化剂(如Cu/ZnO催化剂)作用下,也可合成CH3OH,涉及的反应有:
甲:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) △H= — 53.7kJ·mol-1 平衡常数K1
CH3OH(g)+H2O(g) △H= — 53.7kJ·mol-1 平衡常数K1
乙:CO2(g)+H2(g) ![]() CO(g)+H2O(g) △H= + 41.2kJ·mol-1 平衡常数K2
CO(g)+H2O(g) △H= + 41.2kJ·mol-1 平衡常数K2
①CO(g)+2H2(g) ![]() CH3OH(g)的平衡常数K=______(用含K1、K2的表达式表示),该反应△H_____0(填“大于”或“小于”)。
CH3OH(g)的平衡常数K=______(用含K1、K2的表达式表示),该反应△H_____0(填“大于”或“小于”)。
②提高CO2转化为CH3OH平衡转化率的措施有___________(填写两项)。
③催化剂和反应体系的关系就像锁和钥匙的关系一样,具有高度的选择性。下列四组实验,控制CO2和H2初始投料比均为1:2.2,经过相同反应时间(t1min)。
温度(K) | 催化剂 | CO2转化率(%) | 甲醇选择性(%) | 综合选项 |
543 | Cu/ZnO纳米棒材料 | 12.3 | 42.3 | A |
543 | Cu/ZnO纳米片材料 | 11.9 | 72.7 | B |
553 | Cu/ZnO纳米棒材料 | 15.3 | 39.1 | C |
553 | Cu/ZnO纳米片材料 | 12.0 | 70.6 | D |
由表格中的数据可知,相同温度下不同的催化剂对CO2的转化为CH3OH的选择性有显著影响,根据上表所给数据结合反应原理,所得最优选项为___________(填字母符号)。
(3)以CO、H2为原料合成甲醇的反应为:CO(g)+2H2(g)![]() CH3OH(g)。在体积均为2L的三个恒容密闭容器Ⅰ、Ⅱ、Ⅲ中,分别都充入1molCO和2molH2,三个容器的反应温度分别为T1、T2、T3且恒定不变。下图为三个容器中的反应均进行到5min时H2的体积分数示意图,其中有一个容器反应一定达到平衡状态。
CH3OH(g)。在体积均为2L的三个恒容密闭容器Ⅰ、Ⅱ、Ⅲ中,分别都充入1molCO和2molH2,三个容器的反应温度分别为T1、T2、T3且恒定不变。下图为三个容器中的反应均进行到5min时H2的体积分数示意图,其中有一个容器反应一定达到平衡状态。
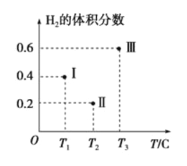
①0~5min时间内容器Ⅱ中用CH3OH表示的化学反应速率为_________________。
②三个容器中一定达到平衡状态的是容器________(填写容器代号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:HCN(aq)与NaOH(aq)反应的△H=-12.1kJ /mol;HCl(aq)与NaOH(aq)反应的△H =-55.6kJ/ mol。则HCN在水溶液中电离的ΔH等于
A. -67.7 kJ /mol B. -43.5kJ /mol C. +43.5 kJ/ mol D. +67.7 kJ/ mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,向10 mL 0.1 mol/LCuCl2溶液中滴加0.1 mol/L的Na2S溶液,滴加过程中溶液中lgc(Cu2+)与Na2S溶液体积(V)的关系如图所示,下列有关说法正确的是
已知:lg2=0.3,Ksp(ZnS)=3×10-25 mol2/L2。

A. a、b、c三点中,水的电离程度最大的为b点
B. Na2S溶液中:c(S2-)+c(HS-)+c(H2S)=2c(Na+)
C. 该温度下Ksp(CuS)=4×10-36 mol2/L2
D. 向100 mL Zn2+、Cu2+浓度均为10-5 molL-1的混合溶液中逐滴加入10-4 molL-1的Na2S溶液,Zn2+先沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 难溶电解质作比较时,KSP小的,溶解度一定小
B. KSP大小取决于难溶电解质的溶解度,所以离子浓度改变时KSP会发生变化
C. 所谓沉淀完全就是用沉淀剂将溶液中某一离子完全除去
D. 温度一定,当溶液中Ag+和Cl—浓度的乘积等KSP时,溶液为AgCl的饱和溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com