
【题目】充分燃烧一种只含C、H、O三种元素的有机物,它们消耗O2和生成CO2的体积比为5:4。
(l)此类中相对分子质量最小的有机物的结构简式为____________;
(2)这类有机物充分燃烧时,生成的CO2和H2O的物质的量之比为1:1。且能发生水解反应的有机物的结构有_____种.
【答案】 CH3CHO 4
【解析】(1)若有机物表示为Cm(H2O)n,则消耗的氧气和生成的二氧化碳的体积比为1:1,实际为5:4,大于1:1,故有机物组成可表示为(CxHy)m(H2O)n,则(x+![]() ):x=5:4,整理得x=y,故该类化合物可以表示为(CH)m(H2O)n;
):x=5:4,整理得x=y,故该类化合物可以表示为(CH)m(H2O)n;
由于H原子为偶数,当m=2、n=1时,这类化合物分子量最小,分子式为C2H4O,结构简式为CH3CHO;
(2)这类有机物充分燃烧时,生成的CO2和H2O的物质的量之比为1:1,说明碳氢之比为1:2,且能发生水解,取为酯的水解,这至少含有一个酯基,即2个氧原子,当O为2的时候,碳原子为4,此时分子式为C4H8O2,相应的酯有甲酸丙酯、甲酸异丙酯,乙酸乙酯和丙酸甲酯,共4种。


科目:高中化学 来源: 题型:
【题目】丙烯是重要的有机化工原料。某科研小组以丙烯和布洛芬为原料合成布洛芬缓释高分子药物J的流程如下:

已知:①不对称结构的烯烃和H2O、H2SO4等加成时,符合如下规律:
![]()
②R-CN ![]() R-COOH(R为烃基)
R-COOH(R为烃基)
③G分子内核磁共振氢谱有两组峰,F与G按物质的量比为l:1反应生成H。
回答下列问题:
(1)CH2=CH—CH,生成A的反应类型为_________,由B生成C的化学方程式为________________
(2)由E生成F的反应类型为______________,F的化学名称是_________________。
(3)由F生成H的化学方程式为_____________。
(4)J用NaOH溶液处理,完全水解后所得产物中高分子化合物的结构简式为______________。
(5)已知:有机物K(C8H8O2)与布洛芬互为同系物,K的同分异构体中,既能发生银镜反应,又能与FeCl3溶液反应的共有________种(不含立体异构)。
(6)已知:RCH===CHCH3![]() RCH===CHCHO。以丙烯为原料(无机试剂任选),设计制备环丙醚(
RCH===CHCHO。以丙烯为原料(无机试剂任选),设计制备环丙醚(![]() )的合成路线______________。
)的合成路线______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:C(s)+H2O(g)=CO(g)+H2(g) △H=a kJ/mol
C(s)+O2(g)=2CO(g) △H=-220 kJ/mol
H-H、O=O和O-H键的键能分别为436、496和462 kJ/mol,则a为( )
A.-332
B.-118
C.+350
D.+130
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是( )
A. 含金属元素的离子一定都是阳离子
B. 酸性氧化物都可以与NaOH溶液反应
C. 金属氧化物都是碱性氧化物
D. 合金一定是由两种或两种以上的金属融合而成的混合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应2SO2+O2![]() 2SO3达到平衡的标志是( )
2SO3达到平衡的标志是( )
①消耗2 mol SO2的同时生成2 mol SO3 ②SO2、O2与SO3的物质的量之比为2∶1∶2
③反应混合物中,SO3的质量分数不再改变 ④恒容条件下压强保持不变
⑤一定体积下气体的密度保持不变 ⑥v正(SO2)=2v逆(O2 )
A. ①②⑤ B. ①③④ C. ③④ D. ③④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿司匹林(主要成分为乙酰水杨酸)是解热止痛、治疗感冒的药物。它是由水杨酸(邻羟基苯甲酸)与醋酸酐进行酯化反应制得的。其反应原理如下:
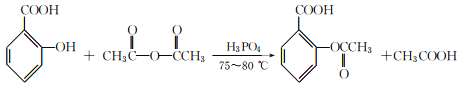
为避免醋酸酐水解,所用原料、仪器要充分干燥。有关物质的参数如下表:
名称 | 式量 | 性质 | 熔点/℃ | 沸点/℃ | 溶解度 | ||
水 | 乙醇 | 乙酸乙酯 | |||||
水杨酸 | 138 | 白色结晶粉末、无臭 | 157~159 | 211 | 溶 | 易溶 | 易溶 |
醋酸酐 | 102 | 无色液体、易燃、有醋酸味 | -73.1 | 138.6 | 易溶 | 溶 | 易溶 |
乙酸水杨酸 | 180 | 白色针状结晶 | 135 | 321.4 | 冰水微溶、热水可溶 | 易溶 | 微溶 |
制取阿司匹林的工艺流程如下:
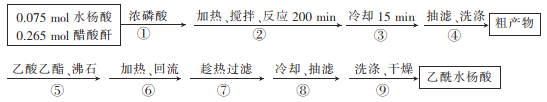
回答下列问题:
(1)浓磷酸的作用是__________。步骤②的加热方式为水浴加热,温度控制在________℃。
(2)向粗产物中加入乙酸乙酯的作用是_________________。
(3)验证最后得到的乙酰水杨酸产品较为纯净的方法是_________________
(4)精制后乙酰水杨酸的质量为8.91 g,则其产率为______,造成产率低的原因可能有__________(任写一点)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E五种短周期元素,其原子序数依次增大,而原子半径按A、C、B、E、D顺序依次增大。A、D同主族;B、D、E三种元素原子的最外层电子数之和为10;E的单质可做半导体材料;C与E两元素形成的化合物可与A、C、D形成的化合物Y发生反应;B元素的气态氢化物与其最高价氧化物的水化物可以发生反应生成化合物M。1molM中含有42mol电子。回答下列问题:
(1)E元素在周期表中的位置________;化合物M中含有的化学键类型有________________
(2)比较B、C、E形成的气态氢化物的稳定性由强到弱的顺序是(用化学式表示):______;写出C与A形成的18e-化合物的结构式_____________;
(3)用电子式表示A2C的形成过程:________________________________________
(4)写出题中生成M的化学方程式_________________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com