
【题目】将少量氯水加入KI溶液中,充分反应后,再加入苯,振荡,静置后观察到的现象是
A. 液体呈黄色,不分层 B. 有紫黑色固体析出
C. 液体分层,上层呈紫红色 D. 液体分层,下层呈紫红色
 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:
【题目】下列仪器和装置,用橡胶管经过简单连接,可制备收集多种不同的纯净、干燥的气体 (考虑尾气吸收)。关于这些装置的连接方法正确的是 ( )

A. 实验室用石灰石与稀盐酸制备收集CO2:b→f→d→e
B. 实验室用锌粒与稀硫酸制备收集H2:b→c→g
C. 实验室利用H2O2与二氧化锰制备收集O2:a→c→e
D. 实验室用浓氨水与生石灰反应制备收集NH3:b→d→e
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某离子反应涉及到 H2O、ClO-、NH4+、OH-、N2、Cl-等微粒,其中N2、ClO-的物质的量随时间变化的曲线如图所示,下列说法不正确的是 ( )
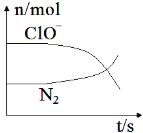
A. 该反应中Cl-为还原产物
B. 氧化剂与还原剂物质的量比为3:2
C. 消耗1 mol还原剂,转移6 mol电子
D. 氧化性:ClO-比 N2强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2018年11月在法国凡尔赛召开的国际计量大会( General Conference on Weights and Measures,CGPM)第26次会议将阿伏加德罗常数的定义修改为“1摩尔包含6.02214076×1023个基本单元,这常数被称为阿伏加德罗常数,单位为mol-1”。基于这一新定义,阿伏加德罗常数的不确定度被消除了。新定义将于2019年5月20日正式生效。NA为阿伏加德罗常数的值。下列说法错误的是
A. 22.4L(标准状况)氖气含有的电子数为10NA
B. 0.4 moI NH3与0.6mo1O2在催化剂的作用下充分反应,得到NO的分子数为0.4NA
C. 27g铝中加入足量1mol·L-1的NaOH溶液,转移的电子数为3NA
D. 常温常压下,水蒸气通过Na2O2使其增重2g时,反应中转移的电子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列仪器:①漏斗、②冷凝管、③蒸馏烧瓶、④玻璃棒、⑤分液漏斗、⑥锥形瓶,其中蒸馏操作不需要的仪器是( )
A.①③④B.①②⑥C.①④⑤D.②③⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式,正确的是( )
A. 甲烷的燃烧热ΔH=-890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为 CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-1
B. 500 ℃、30 MPa下,将0.5 mol N2(g)和1.5 mol H2(g)置于密闭容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为N2(g)+3H2(g)![]() 2NH3(g) ΔH=-38.6 kJ·mol-1
2NH3(g) ΔH=-38.6 kJ·mol-1
C. HCl和NaOH反应的中和热ΔH=-57.3 kJ·mol-1,则H2SO4和Ca(OH)2反应的中和热ΔH=2×(-57.3)kJ·mol-1
D. 在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤燃烧排放的烟气含有 SO2和 NOx,形成酸雨、污染大气。
(1)采用 NaClO2溶液作为吸收剂可同时对烟气进行脱硫、脱硝。在鼓泡反应器中通入含有 SO2和 NO 的烟气,写出 NaClO2溶液脱硝过程中主要反应的离子方程式______________.
(2)NO2与SO2能发生反应:NO2+SO2 ![]() SO3+NO,在固定体积的密闭容器中,使用某种催化剂,改变原料气配比[n0(N02) : n0 (SO2)] 进行多组实验(各次实验的温度可能相同,也可能不同),测定NO2的平衡转化率[α(NO2)]。 部分实验结果如图所示:
SO3+NO,在固定体积的密闭容器中,使用某种催化剂,改变原料气配比[n0(N02) : n0 (SO2)] 进行多组实验(各次实验的温度可能相同,也可能不同),测定NO2的平衡转化率[α(NO2)]。 部分实验结果如图所示:
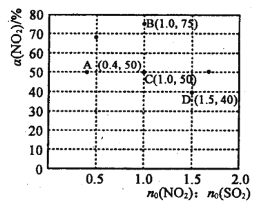
①当容器内________(填标号)不再随时间的变化而改变时,可以判断反应达到了化学平衡状态。
a.气体的压强
b.气体的平均摩尔质量
c.气体的密度
d.N02的体积分数
e.气体的颜色
②如果要将图中C点的平衡状态改变为B点的平衡状态,应采取的措施是__________。
③图中C、D两点对应的实验温度分别为Tc和Td,试判断: Tc_____Td(填“>”、“=”或“<”)。
(3)已知:2NO(g)+O2(g) ![]() 2NO2(g) △H=-113.0 kJ mol-1
2NO2(g) △H=-113.0 kJ mol-1
2SO2(g) + O2(g) ![]() 2SO3(g) △H=-196. 6 kJ mol-1
2SO3(g) △H=-196. 6 kJ mol-1
则 NO2(g)+SO2(g) ![]() SO3(g)+NO(g) △H= ________.
SO3(g)+NO(g) △H= ________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com