
【题目】下列关于各图的叙述正确的是
|
|
|
|
甲 | 乙 | 丙 | 丁 |
A. 图甲表示某可逆反应中物质浓度随时间的变化,反应在t时刻达到平衡状态
B. 图乙表示镁条放入盐酸中生成氢气的速率受温度和浓度的影响
C. 图丙表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则NaA溶液的pH大于同浓度NaB溶液的pH
D. 丁表示向氨水中通入HCl气体,溶液的导电能力变化
【答案】B
【解析】
A项、达到平衡状态时,各物质的浓度保持不变,由图可知,t时刻反应物和生成物的浓度相等,而不是不变,所以t时刻不是平衡状态,故A错误;
B项、镁条与盐酸的反应为放热反应,由图可知,开始一段时间内,离子浓度对化学反应速率影响小于温度对化学反应速率影响,所以反应速率增大,当离子浓度达到一定程度后,离子浓度对化学反应速率影响大于温度对化学反应速率影响,导致反应速率降低,故B正确;
C项、pH相同的酸加水稀释相同的倍数,加水稀释促进弱酸电离,酸性越强的酸,溶液pH变化大;相同浓度的钠盐溶液,酸越弱水解程度越大,钠盐溶液的pH越大,由图可知,HA的酸性强于HB,则NaA溶液的pH小于同浓度NaB溶液的pH,故C错误;
D项、溶液导电性与离子浓度成正比,一水合氨是弱碱,氨水中离子浓度较小,HCl和一水合氨反应生成氯化铵,混合溶液中离子浓度增大,当无限通入氯化氢时,溶液中溶质为氯化铵和氯化氢,离子浓度增大,所以溶液导电能力一直增大,故D错误;
故选B。


 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
活力试卷系列答案科目:高中化学 来源: 题型:
【题目】如图表示土壤中甲、乙两种元素浓度变化与某植物生长速率的关系,下列分析中正确的是

A. 该植物生长对甲元素的需要大于乙元素
B. 在B浓度下施含乙元素的肥料最有利于该植物生长
C. 当该植物生长速率最大时对甲、乙元素的需要量相近
D. 持续保持甲、乙元素供应量相等将导致该植物生长不正常
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列过程所发生的反应属于离子反应的是( )
A.H2O2分解制取O2
B.H2和O2反应生成水
C.加热分解KMnO4制氧气
D.氧化镁投入稀盐酸中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列实验装置进行相应实验,能达到实验目的的是
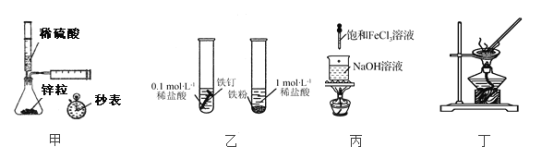
A. 用甲装置测定一定时间内产生氢气的体积,可测定该反应的速率
B. 用乙所示方法探究固体表面积对反应速率的影响
C. 用丙装置制备Fe(OH)3胶体
D. 用丁装置蒸发结晶制AlCl3晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)苏打属于________晶体,与盐酸反应时需要破坏的化学键有_________。
(2)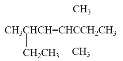 可与H2反应,请用系统命名法对其产物命名_________。
可与H2反应,请用系统命名法对其产物命名_________。
(3)在蔗糖与浓硫酸的黑面包实验中,蔗糖会变黑并膨胀,请用化学方程式解释膨胀的主要原因:_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
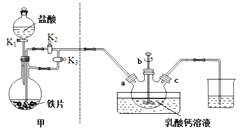
【题目】乳酸亚铁晶体〔CH3CH(OH)COO〕2Fe·2H2O是一种很好的食品铁强化剂,可由乳酸钙与FeCl2反应制得,制备流程如下:
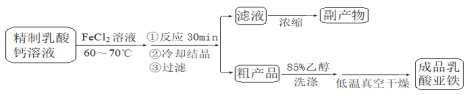
反应装置如下图所示:
已知:①潮湿的乳酸亚铁易被氧化
②物质的溶解性:
乳酸钙:溶于冷水,易溶于热水;乳酸亚铁:溶于冷水和热水,难溶于乙醇。
请回答:
(1)装置甲的气密性检查操作为_________
(2)部分实验操作过程如下,请按正确操作顺序填入字母,其正确的操作顺序是:检查气密性![]() 按图示要求加入试剂
按图示要求加入试剂![]() 将三颈烧瓶置于水浴中
将三颈烧瓶置于水浴中![]() (____)
(____)![]() (____)
(____)![]() (____)
(____)![]() (____)
(____)![]() (____)
(____)![]() (____)
(____)![]() 开动搅拌器
开动搅拌器![]() ……
……
a.关闭K1;
b.盖上分液漏斗上口玻璃塞;
c.关闭K3,打开K2;
d.关闭K2,打开K3;
e.打开分液漏斗上口玻璃塞;
f打开K1
(3)该装置制备乳酸亚铁的优点是_________副产物为_________
(4)下列说法正确的是_________
A.装置甲中的主要仪器是球形分液漏斗和蒸馏烧瓶
B.本实验采用较大铁片而不是铁粉的主要原因是控制反应速率,防止进入三颈烧瓶的氯化亚铁过多,反应过于剧烈
C.乳酸亚铁悬浊液应从b口倒出进行抽滤,并用滤液洗涤三颈烧瓶,将洗涤液倒入布氏漏斗再次抽滤
D.粗产品的洗涤液,经蒸馏后所得的残留液,与滤液混合可提高副产物的产量
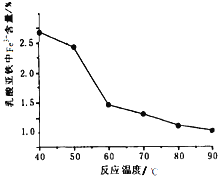
(5)在实验过程中FeCl2溶液和乳酸钙溶液混合即出现浑浊,继续在60℃-70℃下反应30分钟,静置冷却、抽滤、洗涤、低温真空干燥,得到成品,经测定得到反应温度和成品中Fe3+含量关系如图,60℃之后Fe3+含量明显较低的可能的原因是_________
(6)有同学提出可直接用KMnO4滴定法测定样品中的Fe2+量进而计算纯度,但实验后发现结果总是大于100%,其主要原因可能是_________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】欲用98%的浓硫酸(g=1.84g·cm-3)配制成浓度为0.5mol·L-1的稀硫酸500ml。
(1)选用的主要仪器有:
①__________,②__________,③__________,④____________,⑤____________。
(2)请将下列各操作,按正确的序号填在横线上。
A.用量筒量取浓H2SO4 |
B.反复颠倒摇匀 |
C.用胶头滴管加蒸馏水至刻度线 |
D.洗净所用仪器 |
E.稀释浓H2SO4
F.将溶液转入容量瓶
其操作正确的顺序依次为______________________。
(3)简要回答下列问题:
①所需浓硫酸的体积为____________mL。
②如果实验室有15mL、20mL、50mL的量筒应选用____________mL的量筒最好,量取时发现量筒不干净用水洗净后直接量取将使浓度__________(“偏高”、“偏低”、“无影响”)
③将浓硫酸沿烧杯内壁慢慢注入盛水的烧杯中,并用玻璃棒不断搅拌的目的是____________,若搅拌过程中有液体溅出结果会使浓度偏____________。
④在转入容量瓶前烧杯中液体应____________,否则会使浓度偏____________;并洗涤烧杯和玻璃棒2~3次,洗涤液也要转入容量瓶,否则会使浓度____________。
⑤定容时必须使溶液凹液面与刻度线相切,若俯视会使浓度____________;仰视则使浓度___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 是重要的工业原料,铀浓缩一直为国际社会关注。下列说法正确的是
是重要的工业原料,铀浓缩一直为国际社会关注。下列说法正确的是
A. ![]() 原子核中含有92个中子 B.
原子核中含有92个中子 B. ![]() 原子核外有143个电子
原子核外有143个电子
C. ![]() 与
与![]() 互为同位素 D.
互为同位素 D. ![]() 与
与![]() 为同一核素
为同一核素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、W五种短周期元素。X原子的质子数与电子层数相同,W原子核外电子数是M原子最外层电子数的2倍,Y、Z、M、W在周期表中的相对位置如图所示。下列说法不正确的是
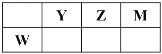
A. 原子半径:W>Y>Z>M>X
B. 热稳定性:XM>X2Z
C. 仅由X、Y、Z三种元素形成的化合物中不可能含离子键
D. WM4分子中每个原子最外层均满足8电子结构
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com