
(14分)亚氯酸钠(NaClO2)常用于水的消毒和砂糖、油脂的漂白与杀菌。以下是用过氧化氢法生产亚氯酸钠的工艺流程图:

己知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出ANClO2.3H2O
②
(1)吸收塔内发生反应的离子方程式为________。该工艺流程中的NaClO3、ClO2、NaClO2都是强氧化剂,它们都能和浓盐酸反应制取Cl2若用二氧化氯和浓盐酸反应制取Cl2,当生成5molCl2 时,通过还原反应制得氯气的质量为________g。
(2)从滤液中得到NaClO2.3H2O晶体的所需操作依次是________(填写序号)。
a.蒸馏
b.灼烧
c.过滤
d.冷却结晶
e.加热蒸发
(3)印染工业常用亚氯酸钠(NaClO2)漂白织物,漂白织物时真正起作用的是HClO2。下表是25℃时HClO2及几种常见弱酸的电离平衡常数:

①常温下,物质的量浓度相等的NaClO2、NaF、NaCN、Na2S四种溶液的pH由大到小的顺序为_________(用化学式表示);
体积相等,物质的量浓度相同的NaF、NaCN两溶液中所含阴阳离子总数的大小关系为:________(填“前者大”“相等”或“后者大”)。
②是常用的沉淀剂。某工业污水中含有等浓度的Cu2+ 、Fe2+ 、Pb2+离子,滴加Na2S 溶液后首先析出的沉淀是________;当最后一种离子沉淀完全时(该离子浓度为l0 mol/L),此时体系中的S2-的浓度为____________.
mol/L),此时体系中的S2-的浓度为____________.
(1)2ClO2+H2O2+2OH-=2ClO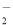 +O2↑+2H2O;71;
+O2↑+2H2O;71;
(2)edc
(3)①Na2S>NaCN>NaF>NaClO2;前者大;②CuS;6.3×10-13mol/L
【解析】
试题分析:(1)吸收塔内的物质为ClO2、NaOH、H2O2,发生氧化还原反应,反应方程式为2ClO2+H2O2+2NaOH=2NaClO2+O2↑+2H2O,离子方程式为2ClO2+H2O2+2OH-=2ClO2-+O2↑+2H2O;用二氧化氯和浓盐酸反应制取Cl2,方程式为2ClO2+8HCl=5Cl2+4H2O,当生成5molCl2时,被还原的Cl2为1mol,质量为71g;
(2)制备晶体需要经过的操作依次是加热蒸发、冷却结晶、过滤、洗涤等;
(3)①由题中所给数据可知,电离平衡常数越大,酸性越强,电离平衡常数越小,酸性越弱,形成盐后,均为强碱弱酸盐,酸性越弱,盐溶液的碱性越强,pH越大,故有Na2S>NaCN>NaF>NaClO2(3);物质的量浓度相同的NaF、NaCN两溶液,由于CN-会发生水解,浓度会减小,故两溶液中所含阴阳离子总数NaF>NaCN;②等浓度的Cu2+、Fe2+、Pb2+离子,滴加Na2S溶液后首先析出的沉淀是Ksp最小的,即为CuS;当最后一种离子沉淀完全时,有Ksp(FeS)=6.3×10-18=c(Fe2+)c(S2-)=10-5c(S2-),解得
c(S2-)=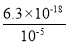 =6.3×10-13mol/L。
=6.3×10-13mol/L。
考点:氧化还原反应的基本计算,溶度积的相关计算
考点分析: 考点1:物质的分离、除杂和提纯 考点2:物质的检验和鉴别 考点3:化学与技术 试题属性

科目:高中化学 来源:2014-2015学年北京市石景山区高三上学期期末考试化学试卷(解析版) 题型:选择题
已知:某元素X的酸式盐(NaHX)溶液显碱性,下列说法正确的是
A.NaHX的电离方程式为NaHX=== Na+ + H+ + X2
B.HX的电离程度小于HX的水解程度
C.离子浓度关系:c(Na+) + c(H+) = c(OH) + c(HX) + c(X2)
D.加水稀释,促进HX水解,c(HX)增大
查看答案和解析>>
科目:高中化学 来源:2014-2015学年北京市海淀区高三年级3月适应性训练理综化学试卷(解析版) 题型:选择题
海水中含有丰富的锂资源,研究人员开发了一种只能让锂离子通过的特殊交换膜,并运用电解实现从海水中提取高浓度的锂盐,其工作原理如图所示。下列说法不正确的是

A.a 连接电源的正极
B.Li+ 的移动方向是从海水进入到盐酸中
C.过程中还可能获得有经济价值的副产物氢气和氯气
D.一段时间后,b电极附近溶液的pH降低
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省文登市高三第二次统考理科综合化学试卷(解析版) 题型:实验题
(17分)草酸晶体的组成可表示为H2C2O4·xH2O。实验室常用其加热分解制取CO气体,反应方程式为:H2C2O4·xH2O  CO+CO2+(x+1)H2O。下图为分解草酸晶体,用干燥纯净的CO还原CuO制取Cu,并收集CO的实验装置(略去铁架台、铁夹等支撑加持装置),回答下列问题。
CO+CO2+(x+1)H2O。下图为分解草酸晶体,用干燥纯净的CO还原CuO制取Cu,并收集CO的实验装置(略去铁架台、铁夹等支撑加持装置),回答下列问题。

(1)A装置为加热分解草酸的装置,该装置错误是_________________,C装置中盛放的试剂是_______ (填化学式),E装置的作用是__________。
(2)实验过程中涉及到如下操作:
①点燃A处的酒精灯
②熄灭A处的酒精灯
③点燃D处的酒精灯
④熄灭D处的酒精灯。
这4步操作由先到后的顺序为_______(填序号)。点燃D处酒精灯前必须要进行的操作名称是__________。
(3)用酸性高锰酸钾溶液滴定草酸晶体,求x的值。
实验步骤:准确称取1.17g 草酸晶体,配成100mL溶液;取出20.00mL于锥形瓶中,再向瓶中加入足量稀H2SO4;用0.0500mol/L酸性高锰酸钾溶液滴定,滴定至终点时消耗高锰酸钾溶液16.00mL。滴定时,所发生的反应为:2MnO4-+5H2C2O4+6H+ = 10CO2+2Mn2++8H2O。
①配制草酸溶液除需要玻璃棒、烧杯,还一定需要的玻璃仪器有_____________。
②x=________。
(4)为探究催化剂对化学反应速率的影响,在甲乙试管中分别加入下列物质
试管 | 0.01mol/L KMnO4 | 0.1mol/L H2C2O4 | 0.1mol/L H2SO4 | MnSO4固体 |
甲 | 4 mL | x mL | 1 mL | 无 |
乙 | y mL | 2mL | 1 mL | 有 |
则x=_______,y=________。能够得出催化剂对该反应有影响结论的实验现象是___________________。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省文登市高三第二次统考理科综合化学试卷(解析版) 题型:选择题
乌头酸的结构简式如图所示,下列关于乌头酸的说法正确的是

A.化学式为C8H6O6
B.乌头酸可发生加成反应和取代反应
C.乌头酸分子中能发生酯化反应的官能团有2种
D.1mol乌头酸与足量的钠反应生成3molH2
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省宁波市高三上学期期末考试化学试卷(解析版) 题型:填空题
(12分)味精厂、化肥厂、垃圾渗滤液等排放的废水中往往含有高浓度的氨氮,若不经处理直接排放会对水体造成严重的污染。
(1)生物硝化法:在富氧条件下,通过硝酸盐菌的作用,将氨氮(以 NH4+表示,下同)氧化成硝酸盐,其反应的离子方程式为 。
(2)MAP 沉淀法:向氨氮废水中投加磷酸盐和镁盐,使之和 NH4+生成难溶复盐MgNH4PO4·6H2O(简称MAP)结晶,是一种比较新颖有效的处理方法。
①用离子方程式表示反应的原理 。
②MAP沉淀法需要控制反应的pH 在 7.5~10 之间。当 pH>10时,由于 而不利于MAP的生成。
(3)电化学氧化法:电化学去除氨氮主要是氯气和次氯酸的间接氧化作用。对某养猪场废水进行电化学氧化处理,选用 IrO2-TiO2/Ti电极作为阳极,阴极采用网状钛板,加入一定量的NaCl,调节溶液的pH,在电流密度为 85 mA·cm-2下电解,180 min内去除率达到98.22%。
①阳极发生的电极反应式是 ; HClO 氧化除去氨氮的反应离子方程式是 。
②为了提高氨氮的去除率,需要控制溶液中 Cl-的浓度和 pH,根据下图判断: Cl-的适宜浓度为 ,适宜的 pH 为 。

查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省宁波市高三上学期期末考试化学试卷(解析版) 题型:选择题
下列有关化学用语表示正确的是
A.“碳铵”的化学式:
B.二氧化碳的结构式:O=C=O
C.钾原子的结构示意图: 
D.中子数为 138、质子数为88 的镭(Ra)原子:
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖北省稳派教育高三一轮复习质量检测理科综合化学试卷(解析版) 题型:选择题
在不同温度下,水溶液中c(H+)与c(OH-)有如图所示关系。下列条件关于离子共存说法中正确的是

A.d点对应的溶液中大量存在:Na+、K+、ClO-、Cl—
B.b点对应的溶液中大量存在:Fe2+、Ba2+、K+、NO3-
C.c点对应的溶液中大量存在:Na+、Ba2+、Cl-、Al3+
D.a点对应的溶液中大量存在:CO32-、Na+、Cl-、SO42-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com