
 ��ͼ����ѧ��ѧijЩ����֮����һ�������µ��ת����ϵ����֪A��һ�ֳ�����Һ̬�����C��D��G��H��K�ǵ��ʣ�����Ϊ�����G��K����ͨ���е�������ҪԪ�أ�����K�����٣�E��F��Ӧ��Һ��������෴��F����ɫ��ӦΪ��ɫ���밴Ҫ������
��ͼ����ѧ��ѧijЩ����֮����һ�������µ��ת����ϵ����֪A��һ�ֳ�����Һ̬�����C��D��G��H��K�ǵ��ʣ�����Ϊ�����G��K����ͨ���е�������ҪԪ�أ�����K�����٣�E��F��Ӧ��Һ��������෴��F����ɫ��ӦΪ��ɫ���밴Ҫ������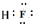 ��
��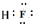 ��
��| 8 |
| 3 |
| 9 |
| 7 |
| 9 |
| 7 |
| 1mol��12g/mol |
| 0.12g |
| ||
| 0.3mol |
| 0.3L |
| 44.8L |
| 22.4L/mol |


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ��ӦA��g��+B��g��?C��g��+D��g�������е������仯��ͼ��ʾ���ش��������⣺
��ӦA��g��+B��g��?C��g��+D��g�������е������仯��ͼ��ʾ���ش��������⣺�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 A��B��C��D��E����Ԫ�����ڱ��е�ǰ20��Ԫ�أ�ԭ��������������B��C��Dͬ���ڣ�A��Dԭ����ijp�ܼ�������5�����ӣ�E������Ԫ�ؼȲ���ͬ����Ҳ����ͬ���壬B��C��D������������ˮ����������Ͼ��ܷ�����Ӧ�����κ�ˮ��
A��B��C��D��E����Ԫ�����ڱ��е�ǰ20��Ԫ�أ�ԭ��������������B��C��Dͬ���ڣ�A��Dԭ����ijp�ܼ�������5�����ӣ�E������Ԫ�ؼȲ���ͬ����Ҳ����ͬ���壬B��C��D������������ˮ����������Ͼ��ܷ�����Ӧ�����κ�ˮ��| 1 |
| 8 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��0.1mol/L NaHCO3��Һ�У�c��H+��+c��Na+��=c��OH-��+c��HCO3-��+c��CO32-�� |
| B��һ����NH4Cl��NH3?H2O������õ�������Һ�У�c��NH4+����c��Cl-�� |
| C��0.2mol/L CH3COOH��Һ�У�c��CH3COOH��+c��CH3COO-��=0.4mol/L |
| D�����ʵ���Ũ����ȵĢ�NH4HSO4��Һ����NH4HCO3��Һ����NH4Cl��Һ�У�c��NH4+���Ĵ�С��ϵ���٣��ڣ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A���ں��ݵ��ܱ������л��������ܶȲ��� |
| B���ں��ݵ��ܱ������л�������ѹǿ���� |
| C��A��B��C��Ũ��֮��Ϊ1��2��1���ұ��ֲ��� |
| D��A������������C������������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A���Ȼ�����Һ��ͨ������������̼��CaCl2+CO2+H2O=CaCO3��+2HCl | ||||
B������������ȼ�գ�Fe+Cl2
| ||||
| C����ú����ȡ���Ľ�������С���и���и���䰵��4Na+O2=2Na2O | ||||
| D����������ˮ���Ȼ�����Һ��Ӧ��Br2+2KCl=2KBr+Cl2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��Ԫ��B��C��D������������Ӧ��ˮ���������Ӧ |
| B��ԭ�Ӱ뾶��D��C��B |
| C��Ԫ��A��B��C���������Ϊ���ۻ����� |
| D�����ʵĻ�ԭ�ԣ�D��C |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com