
【题目】I.下图所示装置,装置A是氢氧燃料电池,已知该装置工作时电子从b极流向Fe电极。
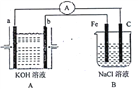
(1)C电极反应式为___________________________。
(2)若装置B中溶液体积为100mL,假设反应前后溶液体积不变,当装置A中消耗0.05mol氢气时,装置B中溶液的pH为_____,此时要恢复原溶液的浓度需加入______(填化学式)。
(3)若将装置B改为电解精炼铜,则粗铜作____极,阴极反应为_________。
II.用零价铁(Fe)去除水体中的的硝酸盐(NO3-)已成为环境修复研究的热点之一。
(1)Fe还原水体中(NO3-)的反应原理如图所示。

①作负极的物质是_______________。②正极的电极反应式是_________________________。
(2)研究证实,CO2也可在酸性水溶液中通过电解生成甲醇,则生成甲醇的反应发生在___极,该电极反应式是_______________________________________________。
【答案】 2Cl--2e-=Cl2↑ 14 HCl 阳 Cu2++2e- =Cu Fe NO3-+8e-+10H+=NH4++3H2O 阴极 CO2+6H++6e-=CH3OH+H2O
【解析】本题主要考查原电池原理及电解池原理。
I.(1) 该装置工作时电子从b极流向Fe电极,Fe电极作阴极,相应地C电极作阳极,反应式为2Cl--2e-=Cl2↑。
(2)A、B两装置的电子守恒,当装置A中消耗0.05mol氢气时,装置B溶液中生成0.1molOH-,c(OH-)=1mol/L,溶液的pH为14,装置B中产生氢气和氯气,此时要恢复原溶液的浓度需加入HCl。
(3)若将装置B改为电解精炼铜,则粗铜作阳极,阴极反应为Cu2++2e- =Cu。
II.(1)①Fe被氧化,作负极的物质是Fe。②由图可知在正极上NO3-被还原为NH4+,正极电极反应式是NO3-+8e-+10H+=NH4++3H2O。
(2)甲醇是还原产物,则生成甲醇的反应发生在阴极,该电极反应式是CO2+6H++6e-=CH3OH+H2O。


 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:高中化学 来源: 题型:
【题目】常温下,取一定量的PbI2固体配成饱和溶液,T时刻改变某一条件,离子浓度变化如图所示,下列有关说法正确的是( )

A.常温下,PbI2的Ksp为2×10-6
B.温度不变,向PbI2饱和溶液中加入少量硝酸铅浓溶液,PbI2的溶解度不变,Pb2+浓度不变
C.T时刻改变的条件是升高温度,因而PbI2的Ksp增大
D.常温下Ksp(PbS)=8×10-28,向PbI2的悬浊液中加入Na2S溶液, PbI2(s)+S2-(aq)![]() PbS(s)+2I-(aq)反应的化学平衡常数为5×1018
PbS(s)+2I-(aq)反应的化学平衡常数为5×1018
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用化学原理可以对工厂排放的废水、废渣等进行有效检测与合理处理。某工厂对制革工业污泥中Cr(III)的处理工艺流程如下:

已知:
①硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+。
②常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
阳离子 | Fe3+ | Mg2+ | Al3+ | Cr3+ |
沉淀完全时的pH | 3.7 | 11.1 | 5.4(>8溶解) | 9(>9溶解) |
(1)酸浸时,为了提高浸取率可采取的措施有_________________(写出两条)。
(2)过滤操作时所用玻璃仪器除烧杯外,还需要________________。
(3)H2O2的作用是将滤液I中的Cr3+转化为C2O72-,该反应的离子方程式为:____________________。
(4)加入NaOH溶液调节溶液pH=8,既可以使溶液中某些杂质离子转化为沉淀,同时又可以将Cr2O72-转化为________(填微粒的化学式),当溶液的pH>8时,沉淀的主要成份为________ (填化学式)。
(5)钠离子交换树脂的反应原理为:Mn++nNaR=MRn+nNa+,则利用钠离子交换树脂可除去滤液Ⅱ中的金属阳离子有________________,交换后溶液中浓度明显增大的离子为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A. △H>0的化学反应一定不能自发进行
B. 反应2NO2(g)![]() N2O4(l)的熵(体系的混乱度)增大(即△S>0)
N2O4(l)的熵(体系的混乱度)增大(即△S>0)
C. FeCl3和MnO2均可加快H2O2分解,同等条件下二者对H2O2分解速率的改变相同
D. Mg(OH)2固体在溶液中存在平衡:Mg(OH)2(s)![]() Mg2+(aq)+2OH-(aq),该固体可溶于NH4Cl溶液
Mg2+(aq)+2OH-(aq),该固体可溶于NH4Cl溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器发生下列反应:aA(g)![]() cC(g)+dD(g),反应达到平衡后,将容器体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是
cC(g)+dD(g),反应达到平衡后,将容器体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是
A. 平衡向正反应方向移动
B. a<c+d
C. D的体积分数增大
D. A的转化率变大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室欲用NaOH固体配制1.0 mol·L-1的NaOH溶液240 mL:
(1)配制溶液时,一般可以分为以下几个步骤:
①称量 ②计算 ③溶解 ④摇匀 ⑤转移 ⑥洗涤 ⑦定容 ⑧冷却 ⑨摇动
其正确的操作顺序为________________。必须用到的玻璃仪器有烧杯、胶头滴管、_________。
(2)某同学欲称量NaOH的质量,他先用托盘天平称量烧杯的质量,天平平衡后的状态如图所示。烧杯的实际质量为________g,要完成本实验该同学应称出________g NaOH。

(3)如图是该同学转移溶液的示意图,图中有两处错误,请写出:

①________________________。
②_____________________________。
(4)在配制过程中,其他操作都是正确的,下列操作会引起误差偏高的是________(填字母)。
A.所用NaOH已经潮解
B.向容量瓶中加水未到刻度线
C.有少量NaOH溶液残留在烧杯里
D.用带游码的托盘天平称5.4 g NaOH(1 g以下用游码)时误用了“左码右物”方法
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com