
【题目】在密闭容器发生下列反应:aA(g)![]() cC(g)+dD(g),反应达到平衡后,将容器体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是
cC(g)+dD(g),反应达到平衡后,将容器体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是
A. 平衡向正反应方向移动
B. a<c+d
C. D的体积分数增大
D. A的转化率变大
【答案】B
【解析】试题分析:假定平衡不移动,将气体体积压缩到原来的一半,D的浓度为原来的2倍,实际再次达到新平衡时,D的浓度为原来的1.8倍,说明压强增大,平衡向逆反应移动,即a<c+d,压强增大,速率加快,新平衡的正、逆速率都大于原平衡;A.气体体积压缩到原来的一半,D的浓度为原来的1.8倍,说明压强增大,平衡向逆反应移动,故A错误;B.气体体积压缩到原来的一半,D的浓度为原来的1.8倍,说明压强增大,平衡向逆反应移动,反应物气体体积小于生成物,a<c+d,故B正确;C.气体体积压缩到原来的一半,D的浓度为原来的1.8倍,说明压强增大,平衡向逆反应移动,D体积分数减小,故C错误;D.平衡向逆反应移动,A的转化率降低,故D错误;故选B。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】一定温度下,用水稀释0.1 mol/L的醋酸溶液,随加水量的增加而增大的是( )
A.n(CH3COOH) B.c(H+) C. c(H+) ·c(OH-) D. c(H+)/c(CH3COOH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.下图所示装置,装置A是氢氧燃料电池,已知该装置工作时电子从b极流向Fe电极。
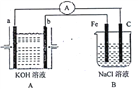
(1)C电极反应式为___________________________。
(2)若装置B中溶液体积为100mL,假设反应前后溶液体积不变,当装置A中消耗0.05mol氢气时,装置B中溶液的pH为_____,此时要恢复原溶液的浓度需加入______(填化学式)。
(3)若将装置B改为电解精炼铜,则粗铜作____极,阴极反应为_________。
II.用零价铁(Fe)去除水体中的的硝酸盐(NO3-)已成为环境修复研究的热点之一。
(1)Fe还原水体中(NO3-)的反应原理如图所示。

①作负极的物质是_______________。②正极的电极反应式是_________________________。
(2)研究证实,CO2也可在酸性水溶液中通过电解生成甲醇,则生成甲醇的反应发生在___极,该电极反应式是_______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原反应和离子反应是高一所学过的重要化学反应类型,仔细思考回答下列问题:
(Ⅰ)下列一组有水参与的反应:
①2Na + 2H2O = 2NaOH + H2↑ ②2Na2O2 + 2H2O = 4NaOH + O2↑
③Na2O + H2O =2NaOH ④2H2O![]() 2H2↑+ O2↑ ⑤2F2 + 2H2O = 4HF + O2
2H2↑+ O2↑ ⑤2F2 + 2H2O = 4HF + O2
(1)其中不属于氧化还原反应的是____________(填编号)
(2)在这些氧化还原反应中,水只作氧化剂的反应是___________(填编号);水只作还原
剂的反应是___________(填编号);水既作氧化剂,又作还原剂是_________(填编号);水既不作氧化剂,又不作还原剂是___________(填编号)。
(3)根据你的理解,氧化还原反应的特征是_____。
A.分子中的原子重新组合 B.氧元素的得失
C.电子的得失或共用电子对的偏移 D.化合价的改变
(4)请你运用所学知识分析3NO2+H2O=2HNO3+NO是否属于氧化还原反应?______(填“是”或“不是”),若是,这个反应的氧化剂是_________,氧化产物是________,被氧化的氮元素与被还原的氮元素的物质的量之比是______;如果3mol的NO2完全反应,应转移____________个电子。
(Ⅱ)现有以下物质:(填序号)
① 铜 ② CO2 ③ 水 ④ CaCO3固体 ⑤ 蔗糖
以上物质中能导电的是______________,以上物质中属于电解质的是____________,以上物质中属于非电解质的________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量纯净的氨基甲酸铵置于密闭真空恒容容器中(固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)![]() 2NH3(g)+CO2(g)。判断该分解反应已经达到化学平衡状态的是( )
2NH3(g)+CO2(g)。判断该分解反应已经达到化学平衡状态的是( )
A. 2v(NH3)=v(CO2) B. 密闭容器中c(NH3)∶c(CO2)=2∶1
C. 密闭容器中混合气体的密度不变 D. 密闭容器中氨气的体积分数不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下说法中正确的是
A. 冰在室温下自动熔化成水,是熵增的重要结果
B. 高锰酸钾加热分解是一个熵减小的过程
C. △H<0的反应均是自发反应
D. △S为负值的反应均不能自发进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应3Cl2+6NaOH==5NaCl+NaClO3+3H2O,以下叙述正确的是( )
A. Cl2是氧化剂,NaOH是还原剂
B. 被氧化的Cl原子和被还原的Cl原子的物质的量之比为5∶1
C. Cl2既做氧化剂又做还原剂
D. 氧化剂得电子数与还原剂失电子数之比为5∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳的化合物在生产生活和环境保护中应用广泛。
Ⅰ.碳氧化合物的综合利用
(1)利用CO可有效降低柴油发动机在空气过量条件下的NO 排放。
已知:反应Ⅰ:2CO(g)+2NO(g)![]() N2(g)+2CO2(g) △H=-746 kJ·mol-1
N2(g)+2CO2(g) △H=-746 kJ·mol-1
反应Ⅱ:4CO(B)+2NO2(g)![]() N2(g)+4CO2(g) △H=-1200kJ·mol-1
N2(g)+4CO2(g) △H=-1200kJ·mol-1
则反应NO2(g)+CO(g)![]() CO2(g)+NO(g)的△H=__________kJ·mol-1。
CO2(g)+NO(g)的△H=__________kJ·mol-1。
在一定条件下,将NO2与CO以体积比1:2置于恒容密闭容器中发生反应Ⅱ,下列能说明反应达到平衡状态的是______________。
a.体系压强保持不变 b.容器中气体密度保持不变
c.混合气体颜色保持不变 d.NO2 与CO的体积比保持不变
(2)工业上利用CO 与Cl2在活性炭催化下合成光(COCl2),反应方程式为: CO(g) +Cl2(g) ![]() COCl2(g) △H<0。某研究小组在恒温条件下,向2L恒容容器中加入0.2molCO和0.2molCl2,10min时达到平衡,测得10min 内v(COCl2)=7.5×10-3mol·L-1·min-1,则平衡时n(Cl2)=________ mol,设此时CO的转化率为a1,若其它条件不变,上述反应在恒压条件下进行,平衡时CO的转化率为a2,则a1_______a2 (填“>”“=”或“<”)
COCl2(g) △H<0。某研究小组在恒温条件下,向2L恒容容器中加入0.2molCO和0.2molCl2,10min时达到平衡,测得10min 内v(COCl2)=7.5×10-3mol·L-1·min-1,则平衡时n(Cl2)=________ mol,设此时CO的转化率为a1,若其它条件不变,上述反应在恒压条件下进行,平衡时CO的转化率为a2,则a1_______a2 (填“>”“=”或“<”)
(3)利用“组合转化技术”可将CO2 转化成乙烯,反应方程式为:6H2(g)+2CO2(g)![]() CH2=CH2(g)+4H2O(g)。实验测得温度对CO2 平衡转化率、催化剂催化效率的影响如图a所示。下列说法正确的是________________
CH2=CH2(g)+4H2O(g)。实验测得温度对CO2 平衡转化率、催化剂催化效率的影响如图a所示。下列说法正确的是________________
a.N点正反应速率一定大于M 点正反应速率
b.250℃时,催化剂的催化效率最大
c.M点平衡常数比N点平衡常数大
d.随着温度升高,乙烯的产率增大
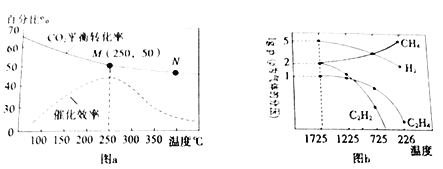
Ⅱ.碳氢化合物的综合利用
利用甲烷的裂解可以制得多种化工原料,甲烷裂解时发生的反应有:2CH4(g)![]() C2H4(g)+2H2(g),2CH4(g)
C2H4(g)+2H2(g),2CH4(g)![]() C2H2(g)+3H2(g) 。实验测得平衡时气体分压(Pa)与温度(℃)之间的关系如图b所示(气体分压=总压×气体的物质的量分数)。
C2H2(g)+3H2(g) 。实验测得平衡时气体分压(Pa)与温度(℃)之间的关系如图b所示(气体分压=总压×气体的物质的量分数)。
(4)1725 ℃时,向1L恒容密闭容器中充入0.3 molCH4达到平衡,则反应2CH4(g)![]() C2H4(g)+2H2(g)的平衡常数KP=___________(用平衡分压代替平衡浓度),CH4生成C2H2 的平衡转化率为__________________。
C2H4(g)+2H2(g)的平衡常数KP=___________(用平衡分压代替平衡浓度),CH4生成C2H2 的平衡转化率为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上可用焦炭、二氧化硅的混合物在高温下与氧气反应生成SiCl4,SiCl4经提纯后用氢气还原得高纯硅。以下是某化学小组制备干景的氧气并在实验室制备SiCl4的部分装置示意图(注: SiCl4遇水易水解)。


(1)选择上图部分装置,制备纯净干燥的氯气,正确的仪器连接顺序为:发生装置甲→___→____→_____→_____→装置A(用小写字母填空)。_____________
(2)上图C装置的作用是_______________。
(3)装置A的硬质玻璃管中二氧化硅和焦炭与氯气恰好完全反应生成SCl4,则二氧化硅和碳的物质的量之比为_________________。
(4)经过讨论,该小组认为D中吸收尾气一段时间后,除了过量的OH-,吸收液中阴离子肯定存在Cl-和SO42-,原因是__________(用离子方程式解释)。
(5)有同学认为可能还存在其它酸根离子(忽略空气中CO2的影响),提出下列假设(不考虑各因素的叠加),假设1:只有SO32-,假设2:只有ClO-,假设3:……
设计实验验证上述假设1和假设2:取少量吸收液于试管中,滴加3mol/LH2SO4至溶液呈酸性,然后将所得溶液分置于a、b两试管中,请填写空白的实验步骤、预期现象。
实验步骤(简述操作过程) | 预期現象 | 结论 |
向a试管中滴加几滴品红溶液,观察现象,加热试管a,观察到 | ____________。 ____________。 | 假设1成立 |
向b试管中滴加______________ | 溶液变为蓝色。 | 假设2成立 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com