
氨水呈弱碱性的主要原因是 ( )
A.通常情况下,氨的溶解度不大
B.氨水中的NH3·H2O电离出少量OH-
C.溶于水的氨分子只有少量电离
D.氨本身的碱性弱
科目:高中化学 来源: 题型:
如图由锌—铜—稀H2SO4组成的原电池装置中,当导线中
有0.2 mol电子通过时,理论上两极的变化是( )
A.铜片增重6.4g B.锌片增重6.5 g
C.铜片上析出0.1 mol O2 D.锌片溶解了6.5 g
|
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关金属铁的腐蚀与防护,说法正确的是
A.酸雨后易发生析氢腐蚀、炒锅存留盐液时易发生吸氧腐蚀
B.当镀锡铁和镀锌铁镀层破损时,后者更易被腐蚀
C.铁与电源正极连接可实现电化学保护
D.将钢管与铜管一起堆放时可保护钢管少受腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
以食盐为原料进行生产并综合利用的某些过程如下图所示。
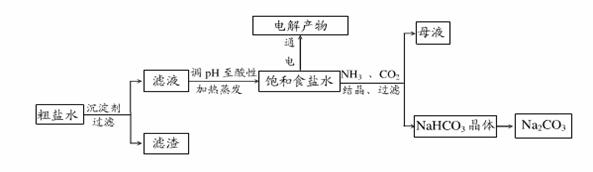
除去粗盐中的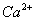 、
、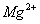 和
和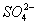 离子,加入下列沉淀剂的顺序是(填序号)_____________ 。
离子,加入下列沉淀剂的顺序是(填序号)_____________ 。
A. 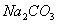 B.
B. 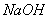 C.
C. 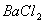
(2)将滤液的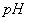 调至酸性除去的离子有___________________。
调至酸性除去的离子有___________________。
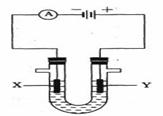
(3)人们习惯上把电解饱和食盐水的工业叫做氯碱工业。下图表示电解饱和NaCl溶液的装置,X、Y是石墨棒。实验开始时,在两边同时各滴入几滴酚酞溶液,请回答以下问题:X极上的电极反应式是_____,在X极附近观察到的现象是________________;Y电极上的电极反应式是______,检验该电极反应产物的方法是_______________ 。电解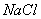 溶液的离子方程式是_____________________。
溶液的离子方程式是_____________________。
(4)若向分离出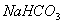 晶体后的母液中加入过量生石灰,则可获得一种可以循环使用的气体,其化学式是 _____________________ 。
晶体后的母液中加入过量生石灰,则可获得一种可以循环使用的气体,其化学式是 _____________________ 。
(5)某同学设计一个燃料电池(如下图所示),目的是探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。
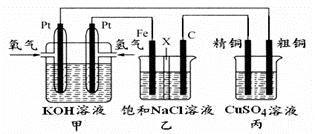
根据要求回答相关问题:
①通入氢气的电极为 (填“正极”或“负极”),负极的电极反应式为 。
②石墨电极为 (填“阳极”或“阴极”),反应一段时间后,在乙装置中滴入酚酞溶液,_ 区(填“铁极”或“石墨极”)的溶液先变红。
③如果粗铜中含有锌、银等杂质,丙装置中反应一段时间,硫酸铜溶液浓度将 ,填“增大”“减 小”或“不变”)。精铜电极上的电极反应式为______________。
④若在标准状况下,有224m L氧气参加反应,则乙装置中铁电极上生成的气体在标况下体积为 ;丙装置中阴极析出铜的质量为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
将NH4HCO3置于干的试管中加热,并使放出的气体依次通过盛有足量过氧化钠和足量碱石灰的干燥
管,最后得到的气体有 ( )
A.NH3 O2 B.H2O O2 C.CO2 O2 D.O2
查看答案和解析>>
科目:高中化学 来源: 题型:
有一种有机物,因其酷似奥林匹克旗中的五环(如右下图),科学家称其为奥林匹克烃,下列有关奥林匹克烃的说法正确的是
A.该烃属于烯烃
B.该烃分子中只含非极性键
C.该烃的二氯代物只有一种
D.该烃完全燃烧生成H2O的物质的量小于CO2的物质的量
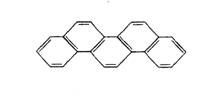
查看答案和解析>>
科目:高中化学 来源: 题型:
对于平衡体系mA(g)+nB(g) 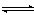 pC(g)+qD(g) ΔH<0。下列结论中错误的是( )
pC(g)+qD(g) ΔH<0。下列结论中错误的是( )
A.若温度不变,将容器的体积缩小到原来的一半,此时A的浓度为原来的2.1倍,则m+n<p+q
B.若平衡时,A、B的转化率相等,说明反应开始时,A、B的物质的量之比为m∶n
C.若m+n=p+q,则往含有a mol气体的平衡体系中再加入a mol的B,达到新平衡时,气体的总物质的量等于2a
D.若温度不变压强增大到原来的2倍,达到新平衡时,总体积一定比原来的1/2要小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com