
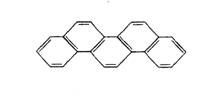
有一种有机物,因其酷似奥林匹克旗中的五环(如右下图),科学家称其为奥林匹克烃,下列有关奥林匹克烃的说法正确的是
A.该烃属于烯烃
B.该烃分子中只含非极性键
C.该烃的二氯代物只有一种
D.该烃完全燃烧生成H2O的物质的量小于CO2的物质的量
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
右图中的每一方格表示相关的一种反应物或生成物。其中B是一种单质,其余物质也都是含B元素的化合物。C是一种钠盐,E是C对应的酸,B的结构类似金刚石,D为B的氧化物(其他不含B元素的反应产物以及各步反应添加的必要试剂和反应条件已被略去)。
请填写空白:
(1)A、D、E的化学式分别为________、________、________。
(2)A和B的互相转化在工业上有什么实际意义?
(3)写出D→C反应的化学方程式:________________。
(4)写出E→D反应的化学方程式:________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
氨水呈弱碱性的主要原因是 ( )
A.通常情况下,氨的溶解度不大
B.氨水中的NH3·H2O电离出少量OH-
C.溶于水的氨分子只有少量电离
D.氨本身的碱性弱
查看答案和解析>>
科目:高中化学 来源: 题型:
元素周期表的一部分,在这11中元素中,按要求完成各小题。
| IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 | |
| 2 | ⑥ | ⑦ | ⑧ | |||||
| 3 | ① | ③ | ⑤ | ⑨ | ⑾ | |||
| 4 | ② | ④ | ⑩ |
(1) 化学性质最不活泼的元素 ,(填元素符号,下同),非金属性最强的元素是 。
金属性最强的单质与水反应的离子方程式为
(2)①③⑤三种元素的原子半径由大到小的顺序为 (填元素符号);这三种元素的最高价氧化物水化物中,碱性最强的 (填化学式)。
(3)⑧⑨⑩三种元素的原子半径由大到小的顺序为 (填元素符号)。
这三种元素的氢化物中,稳定性最强的 (填化学式)。
(4)某元素的最高价氧化物的水化物既能与酸反应生成盐和水又能与碱反应生成盐与水,该元素的最高
价氧化物和盐酸反应的化学方程式为
查看答案和解析>>
科目:高中化学 来源: 题型:
下列化学方程式或离子方程式正确的是
A.H2S在过量的O2中燃烧:2H2S+O2  2H2O+2S
2H2O+2S
B.向稀HNO3中加入过量的铁:Fe+ 4H+ + NO3— == Fe3+ + NO↑+2H2O
C.向稀NH4HSO3溶液中滴加足量的稀NaOH溶液:NH4++OH-=NH3·H2O
D.向氯化铝溶液滴加过量的氨水:Al3+ + 3NH3·H2O == Al(OH) 3↓+3NH4+
查看答案和解析>>
科目:高中化学 来源: 题型:
已知A、B、C、D、E是短周期中原子序数依次增大的5种主族元素,其中元素A、E 的单质在常温下呈气态,元素B的原子最外层电子数是其电子层数的2倍,元素C在同周期的主族元素中原子半径最大,元素D的合金是日常生活中常用的金属材料。下列说法正确的是
A.工业上常用电解法制备元素C、D、E的单质
B.化合物AE和CE含有相同类型的化学键
C.元素A、B组成的化合物常温下一定呈气态
D.一定条件下,元素C、D的最高价氧化物对应的水化物之间不能发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
肼(N2H4)是火箭发动机的燃料,它与N2O4反应时,N2O4为氧化剂,生成氮气和水蒸气。已知:N2(g)+2O2(g)===N2O4(g) ΔH=+8.7 kJ/mol,N2H4(g)+O2(g)===N2(g)+2H2O(g) ΔH=-534.0 kJ/mol,下列表示肼跟N2O4反应的热化学方程式,正确的是( )
A.2N2H4(g)+N2O4(g)===3N2(g)+4H2O(g)
ΔH=-542.7 kJ/mol
B.2N2H4(g)+N2O4(g)===3N2(g)+4H2O(g)
ΔH=-1 059.3 kJ/mol
C.2N2H4(g)+N2O4(g)===3N2(g)+4H2O(g)
ΔH=-1 076.7 kJ/mol
D.N2H4(g)+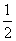 N2O4(g)===
N2O4(g)===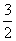 N2(g)+2H2O(g)
N2(g)+2H2O(g)
ΔH=-1 076.7 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
今有室温下四种溶液,有关叙述不正确的是( )
| 序号 | ① | ② | ③ | ④ |
| pH | 11 | 11 | 3 | 3 |
| 溶液 | 氨水 | 氢氧化钠溶液 | 醋酸 | 盐酸 |
A.③④中分别加入适量的醋酸钠晶体后,两溶液的pH均增大
B.②③两溶液等体积混合,所得溶液中c(H+)>c(OH-)
C.分别加水稀释10倍,四种溶液的pH:①>②>④>③
D.V1L④与V2L①溶液混合后,若混合后溶液pH=7,则V1<V2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com