
以食盐为原料进行生产并综合利用的某些过程如下图所示。
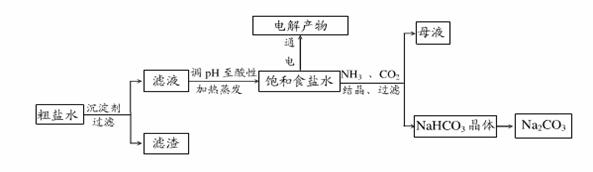
除去粗盐中的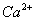 、
、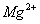 和
和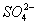 离子,加入下列沉淀剂的顺序是(填序号)_____________ 。
离子,加入下列沉淀剂的顺序是(填序号)_____________ 。
A. 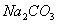 B.
B. 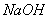 C.
C. 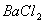
(2)将滤液的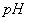 调至酸性除去的离子有___________________。
调至酸性除去的离子有___________________。
(3)人们习惯上把电解饱和食盐水的工业叫做氯碱工业。下图表示电解饱和NaCl溶液的装置,X、Y是石墨棒。实验开始时,在两边同时各滴入几滴酚酞溶液,请回答以下问题:X极上的电极反应式是_____,在X极附近观察到的现象是________________;Y电极上的电极反应式是______,检验该电极反应产物的方法是_______________ 。电解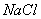 溶液的离子方程式是_____________________。
溶液的离子方程式是_____________________。
(4)若向分离出 晶体后的母液中加入过量生石灰,则可获得一种可以循环使用的气体,其化学式是 _____________________ 。
晶体后的母液中加入过量生石灰,则可获得一种可以循环使用的气体,其化学式是 _____________________ 。
(5)某同学设计一个燃料电池(如下图所示),目的是探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。
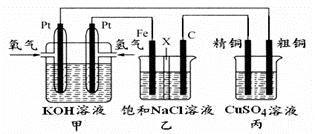
根据要求回答相关问题:
①通入氢气的电极为 (填“正极”或“负极”),负极的电极反应式为 。
②石墨电极为 (填“阳极”或“阴极”),反应一段时间后,在乙装置中滴入酚酞溶液,_ 区(填“铁极”或“石墨极”)的溶液先变红。
③如果粗铜中含有锌、银等杂质,丙装置中反应一段时间,硫酸铜溶液浓度将 ,填“增大”“减 小”或“不变”)。精铜电极上的电极反应式为______________。
④若在标准状况下,有224m L氧气参加反应,则乙装置中铁电极上生成的气体在标况下体积为 ;丙装置中阴极析出铜的质量为 。
【答案】(1)C、A、B 或者C、B、A或者B、C、A ;
(2)CO32-和OH-
(3)2H++2e-=H2↑;有无色气泡产生,溶液变红 ; 2Cl—--2e-=Cl2↑;
将湿润的KI淀粉试纸放在气体出口,若观察到试纸变蓝,证明有Cl2产生;
2Cl—+2H2O Cl2↑+ H2↑+2OH-
Cl2↑+ H2↑+2OH-
(4)NH3
(5)①负极、 H2-2e-+2OH-==2H2O ② 阳极、铁极
③减小 Cu2+ + 2e- -== Cu ④0.448L、 1.28 g
【解析】
试题分析:(1)除去Ca2+用CO32-;除去Mg2+用OH-,除去SO42-用Ba2+。为了将杂质除尽,除杂试剂就要过量。还要按照一定的顺序来除,不然就会使除杂的步骤增多,使实验麻烦,分析应该使SO42-离子在Ca2+离子之前除去,这样加入的CO32-能够将Ca2+和引入来的Ba2+一并除去,其余的杂质无先后关系,因此加入下列沉淀剂的顺序是C、A、B 或者C、B、A或者B、C、A ;(2)将滤液的pH调至酸性除去的离子有CO32-和OH-;(3)根据与电源的连接方式可知:X是阴极,Y是阳极;在阴极由于水电离产生H+放电能力强,所以发生反应2H++2e-=H2↑;由于H+不断放电产生氢气,所以破坏了附近的水的电离平衡,在附近溶液中OH-离子的浓度大于H+的浓度,因此溶液显碱性,使酚酞试液变为红色;在阳极Y电极上由于Cl-放电能力比OH-的强,所以该电极反应式是2Cl—--2e-=Cl2↑; 检验该电极反应产物的方法是将湿润的KI淀粉试纸放在气体出口,若观察到试纸变蓝,证明有Cl2产生;电解NaCl溶液的离子方程式是2Cl—+2H2O Cl2↑+ H2↑+2OH-;(4)分离出NaHCO3晶体后的母液中含有NH4Cl,若向其中加入过量生石灰,则可获得一种可以循环使用的气体,其化学式是NH3 ;(5)①通入氢气的电极为负极,由于电解质溶液是碱性的,所以在该电极反应式为H2-2e-+2OH-==2H2O;②由于石墨电极与电源的正极连接,所以石墨电极为阳极,反应一段时间后,在乙装置中滴入酚酞溶液,溶液中的H+在阴极(Fe电极)放电,平衡了附近的水的电离平衡,该区域的溶液显碱性,因此铁极的溶液先变红。③如果粗铜中含有锌、银等杂质,因为粗铜中有活动性比Cu强的金属失去电子,而得到电子的只有Cu2+,所以丙装置中反应一段时间,硫酸铜溶液浓度会减小;精铜电极上的电极反应式为Cu2+ + 2e- -==Cu ;④若在标准状况下,有224m L氧气参加反应,n(O2)=0.224L÷22.4L/mol=0.01mol,n(e-)=0.04mol由于在整个闭合回路中电子转移数目相等,则乙装置中铁电极上生成的氢气的物质的量是0.02mol,气体在标况下体积为0.02mol×22.4L/mol=0.448L;丙装置中阴极析出铜的质量为0.02mol×64g/mol=1.28g。
Cl2↑+ H2↑+2OH-;(4)分离出NaHCO3晶体后的母液中含有NH4Cl,若向其中加入过量生石灰,则可获得一种可以循环使用的气体,其化学式是NH3 ;(5)①通入氢气的电极为负极,由于电解质溶液是碱性的,所以在该电极反应式为H2-2e-+2OH-==2H2O;②由于石墨电极与电源的正极连接,所以石墨电极为阳极,反应一段时间后,在乙装置中滴入酚酞溶液,溶液中的H+在阴极(Fe电极)放电,平衡了附近的水的电离平衡,该区域的溶液显碱性,因此铁极的溶液先变红。③如果粗铜中含有锌、银等杂质,因为粗铜中有活动性比Cu强的金属失去电子,而得到电子的只有Cu2+,所以丙装置中反应一段时间,硫酸铜溶液浓度会减小;精铜电极上的电极反应式为Cu2+ + 2e- -==Cu ;④若在标准状况下,有224m L氧气参加反应,n(O2)=0.224L÷22.4L/mol=0.01mol,n(e-)=0.04mol由于在整个闭合回路中电子转移数目相等,则乙装置中铁电极上生成的氢气的物质的量是0.02mol,气体在标况下体积为0.02mol×22.4L/mol=0.448L;丙装置中阴极析出铜的质量为0.02mol×64g/mol=1.28g。
考点:考查以食盐为原料进行生产并综合利用的知识。主要包括粗盐的提纯、原电池、电解池、金属的精炼及有关计算的知识。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
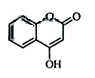
是一种医药中间体,常用来制备抗凝血药,可通过下列路线合成:
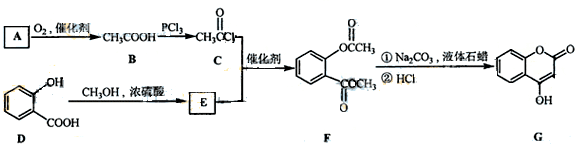 (1)A与银氨溶液反应有银镜生成,则A的结构简式是 。
(1)A与银氨溶液反应有银镜生成,则A的结构简式是 。
(2)B→C的反应类型是 。
(3)E的结构简式是
(4)写出F和过量NaOH溶液共热时反应的化学方程式
(5)下列关于G的说法正确的是 。
a.能与溴单质反应 b. 能与金属钠反应
c. 1molG最多能和3mol氢气反应 d. 分子式是C9H6O3
查看答案和解析>>
科目:高中化学 来源: 题型:
右图中的每一方格表示相关的一种反应物或生成物。其中B是一种单质,其余物质也都是含B元素的化合物。C是一种钠盐,E是C对应的酸,B的结构类似金刚石,D为B的氧化物(其他不含B元素的反应产物以及各步反应添加的必要试剂和反应条件已被略去)。
请填写空白:
(1)A、D、E的化学式分别为________、________、________。
(2)A和B的互相转化在工业上有什么实际意义?
(3)写出D→C反应的化学方程式:________________。
(4)写出E→D反应的化学方程式:________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
利用下图装置可以模拟铁的电化学防护。下列说法不正确的是
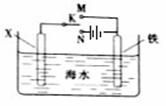
A. 若X为锌棒,开关K置于M处,可减缓铁的腐蚀
B. 若X为锌棒,开关K置于M处,铁极发生氧化反应
C. 若X为碳棒,开关K置于N处,可减缓铁的腐蚀
D. 若X为碳棒,开关K置于N处,X极发生氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
关于图中各装置的叙述不正确的是
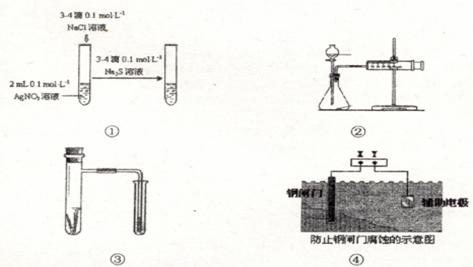
A. 装置①能验证AgCl沉淀可转化为溶解度更小的Ag2S沉淀
B. 装置②能测量锌与硫酸的反应速率
C. 装置③能验证铁的吸氧腐蚀
D. 装置④的X电极是负极,则能验证外接电源的阴极保护法
查看答案和解析>>
科目:高中化学 来源: 题型:
氨水呈弱碱性的主要原因是 ( )
A.通常情况下,氨的溶解度不大
B.氨水中的NH3·H2O电离出少量OH-
C.溶于水的氨分子只有少量电离
D.氨本身的碱性弱
查看答案和解析>>
科目:高中化学 来源: 题型:
肼(N2H4)是火箭发动机的燃料,它与N2O4反应时,N2O4为氧化剂,生成氮气和水蒸气。已知:N2(g)+2O2(g)===N2O4(g) ΔH=+8.7 kJ/mol,N2H4(g)+O2(g)===N2(g)+2H2O(g) ΔH=-534.0 kJ/mol,下列表示肼跟N2O4反应的热化学方程式,正确的是( )
A.2N2H4(g)+N2O4(g)===3N2(g)+4H2O(g)
ΔH=-542.7 kJ/mol
B.2N2H4(g)+N2O4(g)===3N2(g)+4H2O(g)
ΔH=-1 059.3 kJ/mol
C.2N2H4(g)+N2O4(g)===3N2(g)+4H2O(g)
ΔH=-1 076.7 kJ/mol
D.N2H4(g)+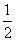 N2O4(g)===
N2O4(g)===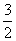 N2(g)+2H2O(g)
N2(g)+2H2O(g)
ΔH=-1 076.7 kJ/mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com