
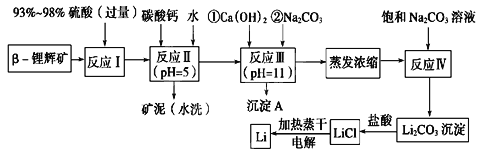
����Ŀ��ﮱ���Ϊ������ζ��������LiCoO2Ϊ��������������ӵ���ѱ��㷺������Яʽ��Դ����ҵ��������-﮻Կ�(��Ҫ�ɷ�ΪLiAlSi2O6��������FeO��MgO��CaO������)Ϊԭ������ȡ����ﮡ�����һ�ֹ���������ͼ��ʾ��
��֪�������ֽ����������↑ʼ��������ȫ����ʱ��pH���±���
�������� | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
��ʼ����pH | 2.7 | 3.7 | 9.6 |
��ȫ����pH | 3.7 | 4.7 | 11 |
��Li2CO3�ڲ�ͬ�¶��µ��ܽ�����±���
�¶�/�� | 0 | 10 | 20 | 50 | 75 | 100 |
Li2CO3���ܽ��/g | 1.539 | 1.406 | 1.329 | 1.181 | 0.866 | 0.728 |
��ش��������⣺
��1������������ʽ��ʾLiAlSi2O6����ɣ�________________________��
��2����Ӧ������̼�����������___________________��
��3������������ʹ��̼������Һ����˵��ǰ������ʹ����Ũ�Ȳ�ͬ��ԭ��______________��
��4��ϴ������Li2CO3����Ҫʹ��________(������ˮ��������ˮ��)����ѡ���������________________��
��5����������Li2CO3��ȫ��Ӧ�����Һ���������ɵõ����壬�ٽ��������������ﮡ����ʱ�����������л��������������ԭ���ǣ�__________________________��
��6�����й��ڽ���﮼��������˵����ȷ����___________������ţ���
A����Ǽ���������۵������ B�����ݶԽ���ԭ�����������ǿ��
C������﮵���������ʽʮ�ָ��� D����������ܶ���С����ﮣ��������
���𰸡���1��Li2O��Al2O3��4SiO2 ��2����ȥ��Ӧ���й�����H2SO4������pH��ʹFe3����Al3����ȫ����
��3����һ��Ũ�ȹ����ʹ����Li+ �������ڶ���Ũ�ȴ���������Li2CO3����������
��4����ˮ,Li2CO3�ڽϸ��¶����ܽ��С������ˮϴ�ӿɼ���Li2CO3�����
��5����������LiCl��Һʱ��LiCl������ˮ������LiOH�����ȷֽ�����Li2O�����ʱ����O2
��6��A
��������
�����������1�������μȿ������ε���ʽ��ʾ��Ҳ���������������ʽ��ʾ��������������ʽ��ʾʱҪ���������غ㶨�ɡ���һ������£�����������д��ǰ�棬�ǽ���������д�ں��档��LiAlSi2O6�����������ʽ��ʾΪLi2O��Al2O3��4SiO2��
��2����Ӧ�����̼�����Ϊ�˳�ȥ��Ӧ���й�����H2SO4������pH��ʹFe3����A l3����ȫ������
��3����һ��Ũ�ȹ����ʹ����Li+�������ڶ���Ũ�ȴ���������Li2CO3���������ɣ���������������ʹ����Na2CO3��Һ����һ��Ũ��С���ڶ���Ũ�ȴ�
��4����Ӧ��������Li2CO3�ܽ��С����������Li2CO3��������ʵ�����д���Һ�з���õ�Li2CO3�����IJ����ǹ��ˡ���ΪLi2CO3���ܽ�����¶ȵ����߶����ͣ�����ϴ������Li2CO3����Ҫʹ����ˮ��������Li2CO3�ڽϸ��¶����ܽ��С������ˮϴ�ӿɼ���Li2CO3����ġ�
��5����������Ȼ�������ʱ�����������������л����������������Ϊ�ڼ�������LiCl��Һʱ��LiCl����������ˮ�ⷴӦ����LiOH�������ȷֽ�����Li2O�����ʱ����O2�������ȡ�������г�����������O2��
��6��A����Ǽ���������۵�����ƣ�A��ȷ��B��Li��Mg���ڶԽ���λ�ã����ݶԽ���ԭ���������Ӧ�������B����C������﮵�������ֻ��һ��Li2O��C����D����������ܶ���С����ﮣ�����Ǽأ�D����ѡA��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ӧ4NH3��g��+5O2��g��4NO��g��+6H2O��g����2L���ܱ������н��У�1min��NH3������0.12mol����ƽ��ÿ����Ũ�ȱ仯��ȷ����
A��NO��0.06molL��1 B��H2O��0.002molL��1
C��NH3��0.002molL��1 D��O2��0.00125molL��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�̶�������ܱ������У�������������A�ﻯѧƽ�⣺ aA(g)![]() B(g)+c(g)�����¶Ȳ���������£��ٳ���һ������A���ʣ����´ﵽƽ��ʱ�������ж�����ȷ����
B(g)+c(g)�����¶Ȳ���������£��ٳ���һ������A���ʣ����´ﵽƽ��ʱ�������ж�����ȷ����
A. ��a��b��cʱ��B�����ʵ���������� B. ��a��b��cʱ��B�����ʵ�����������
C. ��a��b��cʱ��A��ת���ʲ��� D. ��a��b��cʱ��A��ת���ʱ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ���̶�������ܱ������У�����4mol A��2mol B������Ӧ��2A��g��+B��g��![]() 3C��g��+D��g���ﵽƽ��ʱ��C��Ũ��ΪWmol/L����ά������������¶Ȳ��䣬���������ַ����ı���ʼ���ʣ��ﵽƽ���C��Ũ����ΪWmol/L���ǣ� ��
3C��g��+D��g���ﵽƽ��ʱ��C��Ũ��ΪWmol/L����ά������������¶Ȳ��䣬���������ַ����ı���ʼ���ʣ��ﵽƽ���C��Ũ����ΪWmol/L���ǣ� ��
A��8mol A+4mol B B��2mol A+1mol B
C��6mol C+2mol D+2mol B D��6mol C+2mol D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������������������������ӵ�ԾǨ�ص���
A. ȼ����� B. ��ƹ�� C. ȼ������ D. ƽ�澵����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��1molL��1Na2SO4��Һ�ĺ����ǣ� ��
A.1L��Һ�к�142gNa2SO4
B.1L��Һ�к���1molNa+
C.��142gNa2SO4����1Lˮ�������Һ
D.1Lˮ�к���1molNa2SO4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪����273K��101Kpa�������£�ij���壺������Ϊm������Է�������ΪM�������ΪV�����ܶ�Ϊ�ѣ�������������ΪN�������ӵ�����ΪNA����ͨ������������������������ʵ���
���ǣ� ��
A���٢� B���� C���� D���ڢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1��ijN2H4(�»�����)ȼ�ϵ��(�����ȶ�������Ⱦ������)ԭ����ͼ1��ʾ��
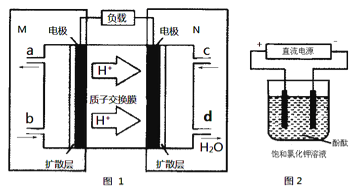
��M�������ĵ缫��ӦʽΪ___________��
���������������Դ����ͼ2װ�õ�ⱥ���Ȼ�����Һ(�缫��Ϊ���Ե缫)���豥���Ȼ�����Һ���Ϊ500mL������Һ��pHֵ��Ϊ13ʱ(�ڳ����²ⶨ)������ȼ�ϵ�ص�����������Ϊ80%����������N2H4������Ϊ__________g(������Һ���ǰ���������)��
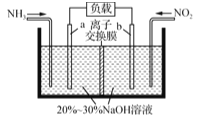
��2�������÷�ӦNO2��NH2�D��N2��H2O(δ��ƽ)����NO2�ļ���װ����ͼ��ʾ���缫b�ĵ缫��ӦʽΪ______________�����ı�״����4.48 L NH3ʱ����������NO2�����ʵ���Ϊ________mol��
���ϳɰ���ԭ��������������һ�������ǣ�����Na2CO3��Һ����H2S����NaHS��NaHS����NaVO3��Ӧ����S��Na2V4O9������X��NaHS����NaVO3��Ӧ�Ļ�ѧ����ʽΪ____________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com