
【题目】下列微粒中,最外层未成对电子数最多的是( )
A. O B. Fe3+ C. Si D. P
科目:高中化学 来源: 题型:
【题目】X,Y,Z均为短周期元素,它们的原子核外最外层电子数分别为1、6、6,Z位于Y的上一周期,则这三种元素形成的某种化合物的化学式可能为( )
A.X2YZ4
B.XY2Z3
C.X3YZ4
D.XYZ3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.已知常温下E为无色无味的液体,F为淡黄色粉末,G为常见的无色气体(反应条件均已略去) ,请回答下列问题:
(1)请写出F的化学式 ;在②反应中,当生成2.24L的G(标准状况)时,反应中转移的电子的物质的量为 moL。
(2)若A、C、D均含有氯元素,且A中的化合价介于C与D之间,写出反应①的离子方程式: 。
(3)若C、D均为气体且都能使澄清石灰水变浑浊,则A与B分别为 、 。(写化学式)
(4)若A与B均为固体化合物,D是一种能使湿润的红色石蕊试纸变蓝的气体,反应①是实验室制备D的反应,则反应①的化学方程式为 。
Ⅱ.A、B、C是中学化学常见的三种物质,它们之间的相互转化关系如下(部分反应产物略去)。
![]()
(1)若A是一种黄色非金属单质固体,则B→C的化学方程式为 。
(2)若A是一种活泼金属,C是淡黄色固体,则C的电子式为 ,写出C和CO2反应的化学方程式,并标出单线桥 。
(3)若A是碱性气体,试写出A与氧气反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与人类生产、生活、社会可持续发展密切相关,下列说法正确的是( )
A. 凡含有添加剂的食物对人体健康均有害,不宜食用
B. “霾尘积聚难见路人”,雾霾所形成的气溶胶有丁达尔效应
C. 人体缺乏铁元素,可以补充硫酸亚铁,且多多益善
D. “青蒿一握,以水二升渍,绞取汁”,屠呦呦对青蒿素的提取属于化学变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,在体积为2L的密闭容器中,气态物质A、B、C的物质的量n(mo1)随时间t的变化如图2-10-2所示。已知达平衡后,降低温度,A的转化率将增大。
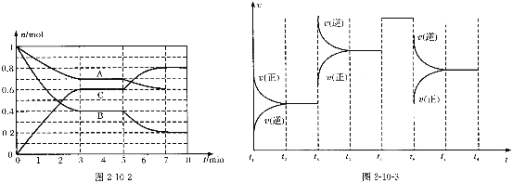
(1)根据图2-10-2数据,写出该反应的化学方程式________________;此反应的平衡常数表达式K=______________。从反应开始到达第一次平衡时的平均反应速率v(A)为_________。
(2)在5~7min内,若K值不变,则此处曲线变化的原因是________________。
(3)图2-10-3表示此反应的反应速率v和时间t的关系。各阶段的平衡常数如下表所示:
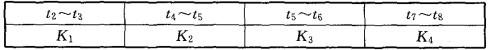
根据图2-10-3判断,在t3和t6时刻改变的外界条件分别是__________和____________;K1、K2、K3、K4之间的关系为__________(用“>”“<”或“=”连接)。平衡时A的转化率最大的一段时间是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质应用于其性质密切相关,下列说法错误的是
A. 硅胶可防止食物受潮是由于其具有吸水性
B. 酸性重铬酸钾用于检查酒驾是利用其强氧化性
C. 用菜籽油浸泡花椒制得花椒油的过程主要利用物理性质
D. 河水中有许多杂质和有害细菌,加入明矾消毒杀菌后可以饮用
查看答案和解析>>
科目:高中化学 来源: 题型:
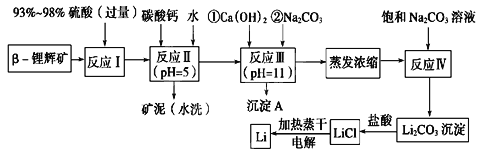
【题目】锂被誉为“金属味精”,以LiCoO2为正极材料的锂离子电池已被广泛用作便携式电源。工业上常以β-锂辉矿(主要成分为LiAlSi2O6,还含有FeO、MgO、CaO等杂质)为原料来制取金属锂。其中一种工艺流程如图所示:
已知:①部分金属氢氧化物开始沉淀和完全沉淀时的pH如下表:
氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
开始沉淀pH | 2.7 | 3.7 | 9.6 |
完全沉淀pH | 3.7 | 4.7 | 11 |
②Li2CO3在不同温度下的溶解度如下表:
温度/℃ | 0 | 10 | 20 | 50 | 75 | 100 |
Li2CO3的溶解度/g | 1.539 | 1.406 | 1.329 | 1.181 | 0.866 | 0.728 |
请回答下列问题:
(1)用氧化物形式表示LiAlSi2O6的组成:________________________。
(2)反应Ⅱ加入碳酸钙的作用是___________________。
(3)流程中两次使用碳酸钠溶液,请说明前后两次使用中浓度不同的原因:______________。
(4)洗涤所得Li2CO3沉淀要使用________(填“热水”或“冷水”),你选择的理由是________________。
(5)将盐酸与Li2CO3完全反应后的溶液,加热蒸干得到固体,再将其熔融电解生产锂。电解时产生的氯气中会混有少量氧气,原因是:__________________________。
(6)下列关于金属锂及碱金属的说法正确的是___________(填序号)。
A.锂是碱金属,其熔点高于钠 B.根据对角线原则,氢氧化锂是强碱
C.金属锂的氧化物形式十分复杂 D.碱金属中密度最小的是锂,其次是钠
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com