
【题目】25℃时,在体积为2L的密闭容器中,气态物质A、B、C的物质的量n(mo1)随时间t的变化如图2-10-2所示。已知达平衡后,降低温度,A的转化率将增大。
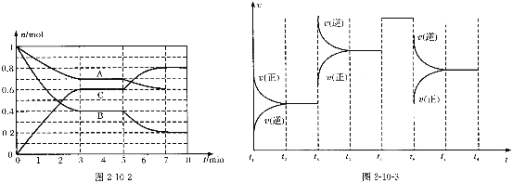
(1)根据图2-10-2数据,写出该反应的化学方程式________________;此反应的平衡常数表达式K=______________。从反应开始到达第一次平衡时的平均反应速率v(A)为_________。
(2)在5~7min内,若K值不变,则此处曲线变化的原因是________________。
(3)图2-10-3表示此反应的反应速率v和时间t的关系。各阶段的平衡常数如下表所示:
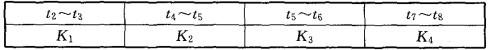
根据图2-10-3判断,在t3和t6时刻改变的外界条件分别是__________和____________;K1、K2、K3、K4之间的关系为__________(用“>”“<”或“=”连接)。平衡时A的转化率最大的一段时间是____________。
【答案】(1)A+2B![]() 2C
2C ![]() 0.05mol·L—1·min—1
0.05mol·L—1·min—1
(2)加压 (3)升温 减压 K1﹥K2=K3=K4 t2~t3
【解析】
试题分析:(1)由图1可知,A、B为反应物,C为生产物,且最后A、B的物质的量不为0,为可逆反应,3min时△n(A):△n(B):△n(C)=(1-0.7)mol:(1-0.4)mol:0.6mol=1:2:2,物质的量之比等于化学计量数之比,所以反应方程式为A+2B![]() 2C;平衡常数为生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值,所以k=
2C;平衡常数为生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值,所以k=![]() ;从反应开始到达第一次平衡时的平均速率v(A)=
;从反应开始到达第一次平衡时的平均速率v(A)=![]() =0.05mol/(Lmin);
=0.05mol/(Lmin);
(2)K值不变,温度不变,由图1可知,5min时各组分的物质的量不变,且平衡向正反应移动,只能改变压强,由反应为前后气体体积减小的反应,故应增大压强;
(3)降低温度,A的转化率将增大,反应向正反应进行,所以正反应为放热反应,该反应为前后气体体积减小的反应;t3时刻,正逆反应速率都增大,且逆反应速率变化大,平衡向逆反应移动,应为升高温度,所以K1>K2;t6时刻,正逆反应速率都减小,且正反应速率变化大,平衡向逆反应移动;应为降低压强,所以K3=K4;t5~t6正逆速率都增大,平衡不移动,应是使用催化剂,k不变,所以K2=K3,所以K1>K2=K3=K4,所以t2~t3段A的转化率最高。


 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案科目:高中化学 来源: 题型:
【题目】现往1L的容器中通入CO2、H2各2mol。在一定条件下让其发生反应:CO2+H2![]() CO+H2O,回答下列问题:
CO+H2O,回答下列问题:
(1)在830℃条件下,反应达到平衡时CO2的浓度为1mol·L-1。该条件下平衡常数K1=________。
(2)在(1)基础上,把体系的温度降至800℃。已知该条件下的平衡常数K2=0.81,可以推知平衡时c(H2O)=______________(保留2位有效数字)。
(3)该可逆反应的正反应为________反应(填“吸热”或“放热”)。
(4)在(1)基础上,压缩容器体积至0.5L。该条件下的平衡常数为K3。则K3________(填“大于”、“等于”或“小于”)K1,理由是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于晶体的下列说法正确的是 ( )
A. 原子晶体中只含有共价键
B. 任何晶体中,若含有阳离子就一定有阴离子
C. 原子晶体的熔点一定比金属晶体的高
D. 离子晶体中含有离子键,不可能含有共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.离子化合物中可能含有共价键
B.共价化合物中可能含有离子键
C.离子化合物中只含离子键
D.只含共价键的物质一定是共价化合物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com