
【题目】(1)某N2H4(肼或联氨)燃料电池(产生稳定、无污染的物质)原理如图1所示。
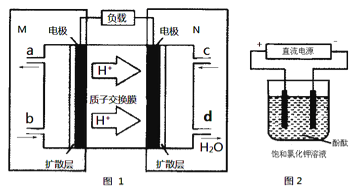
①M区发生的电极反应式为___________。
②用上述电池做电源,用图2装置电解饱和氯化钾溶液(电极均为惰性电极),设饱和氯化钾溶液体积为500mL,当溶液的pH值变为13时(在常温下测定),若该燃料电池的能量利用率为80%,则需消耗N2H4的质量为__________g(假设溶液电解前后体积不变)。
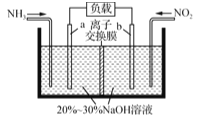
(2)①利用反应NO2+NH2―→N2+H2O(未配平)消除NO2的简易装置如图所示。电极b的电极反应式为______________;消耗标准状况下4.48 L NH3时,被消除的NO2的物质的量为________mol。
②合成氨的原料气需脱硫处理。一种脱硫方法是:先用Na2CO3溶液吸收H2S生成NaHS;NaHS再与NaVO3反应生成S、Na2V4O9和物质X。NaHS再与NaVO3反应的化学方程式为____________。
【答案】(1)①N2H4-4e-=N2↑+4H+(2分)②0.5(2分)
(2)①2NO2+8e-+4H2O=8OH-+N2;0.15
②2NaHS+4NaVO3+H2O=Na2V4O9+2S↓+4NaOH
【解析】
试题分析:(1)①原电池中阳离子向正极移动,则根据氢离子的移动方向可判断M电极是负极,发生失去 电子的氧化反应,由于生成物是没有污染的,则氧化产物是氮气因此则M区发生的电极反应式为N2H4-4e-=N2↑+4H+。
②反应中生成氢氧化钾的物质的量是0.1mol/L×0.5L=0.05mol,根据方程式2KCl+2H2O![]() 2KOH+H2↑+Cl2↑可知转移0.05mol电子。因此根据电子得失守恒可知消耗肼的质量是
2KOH+H2↑+Cl2↑可知转移0.05mol电子。因此根据电子得失守恒可知消耗肼的质量是![]() 。
。
(2)①电极b通入NO2,发生得到电子的还原反应,则电极反应式为2NO2+8e-+4H2O=8OH-+N2;消耗标准状况下4.48 L NH3即0.2mol氨气时,根据电子得失守恒可知被消除的NO2的物质的量为![]() 。
。
②NaHS再与NaVO3反应生成S、Na2V4O9和物质X,根据电子得失守恒和原子守恒可知X是氢氧化钠,则NaHS再与NaVO3反应的化学方程式为2NaHS+4NaVO3+H2O=Na2V4O9+2S↓+4NaOH。


 出彩同步大试卷系列答案
出彩同步大试卷系列答案科目:高中化学 来源: 题型:
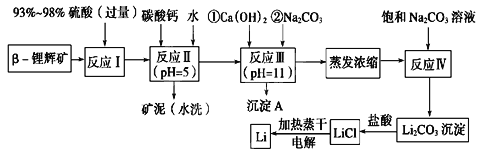
【题目】锂被誉为“金属味精”,以LiCoO2为正极材料的锂离子电池已被广泛用作便携式电源。工业上常以β-锂辉矿(主要成分为LiAlSi2O6,还含有FeO、MgO、CaO等杂质)为原料来制取金属锂。其中一种工艺流程如图所示:
已知:①部分金属氢氧化物开始沉淀和完全沉淀时的pH如下表:
氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
开始沉淀pH | 2.7 | 3.7 | 9.6 |
完全沉淀pH | 3.7 | 4.7 | 11 |
②Li2CO3在不同温度下的溶解度如下表:
温度/℃ | 0 | 10 | 20 | 50 | 75 | 100 |
Li2CO3的溶解度/g | 1.539 | 1.406 | 1.329 | 1.181 | 0.866 | 0.728 |
请回答下列问题:
(1)用氧化物形式表示LiAlSi2O6的组成:________________________。
(2)反应Ⅱ加入碳酸钙的作用是___________________。
(3)流程中两次使用碳酸钠溶液,请说明前后两次使用中浓度不同的原因:______________。
(4)洗涤所得Li2CO3沉淀要使用________(填“热水”或“冷水”),你选择的理由是________________。
(5)将盐酸与Li2CO3完全反应后的溶液,加热蒸干得到固体,再将其熔融电解生产锂。电解时产生的氯气中会混有少量氧气,原因是:__________________________。
(6)下列关于金属锂及碱金属的说法正确的是___________(填序号)。
A.锂是碱金属,其熔点高于钠 B.根据对角线原则,氢氧化锂是强碱
C.金属锂的氧化物形式十分复杂 D.碱金属中密度最小的是锂,其次是钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在空气中直接蒸发下列盐的溶液:①Fe2(SO4)3 ②Na2CO3③KC1 ④CuCl2 ⑤NaHCO3可以得到相应盐的晶体(可以含有结晶水)的是( )
A. ①③⑤ B. ①②③ C. ②④ D. ①③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中,反应 a A(g)![]() b B(g)+c C(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的70%,以下不正确的是( )
b B(g)+c C(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的70%,以下不正确的是( )
A. 平衡向正反应方向移动了
B. 物质A的转化率减少了
C. 物质B的质量分数增加了
D. a<b+c
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列情况没有发生蛋白质变性的是( )
A.用福尔马林浸动物标本 B.用蘸有质量分数为75%的酒精棉花球擦皮肤
C.用紫外线光灯照射病房 D.淀粉和淀粉酶混合后微热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列电离方程式,书写正确的是( )
A.FeCl3═Fe3++Cl3﹣
B.NaHCO3═Na++H++CO32﹣
C.Al2(SO4)3═2Al3++3SO42﹣
D.KMnO4═K++Mn7++4O2﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列判断正确的是( )
①维生素C具有还原性,在人体内起抗氧化作用
②NO2溶于水时发生氧化还原反应
③1 mol Cl2参加反应转移电子数一定为2NA
④阴离子都只有还原性
A. ①② B. ②③ C. ③④ D. ①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究NO2、SO2、CO等大气污染气体的处理具有重要意义。
(1)一定温度下,在2L的密闭容器中,SO2、O2、SO3三种气体的物质的量随时间变化的曲线如下图所示,请回答下列问题:
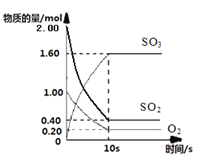
①反应的化学方程式为
②反应开始到10s,用SO2表示的反应速率为
③O2的平衡转化率为
(2)对于反应:2SO2(g)+O2(g)![]() 2SO3(g),当反应达到平衡时,如果反应速率υ(SO2)为0.05 mol·L-1·min-1,则υ(O2)= ;υ(SO3)= 。
2SO3(g),当反应达到平衡时,如果反应速率υ(SO2)为0.05 mol·L-1·min-1,则υ(O2)= ;υ(SO3)= 。
(3)已知:2SO2(g)+O2(g)![]() 2SO3(g)ΔH=-196.6kJ·mol-1
2SO3(g)ΔH=-196.6kJ·mol-1
2NO(g)+O2(g)![]() 2NO2(g)ΔH=-113.0kJ·mol-1
2NO2(g)ΔH=-113.0kJ·mol-1
则反应NO2(g)+SO2(g) ![]() SO3(g)+NO(g)的ΔH=_________kJ·mol-1。
SO3(g)+NO(g)的ΔH=_________kJ·mol-1。
(4)一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是_________
a、体系压强保持不变 b、混合气体颜色保持不变
c、SO3和NO的体积比保持不变 d、每消耗1 mol SO3的同时生成1 mol NO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】羰基硫(COS)可作为一种熏蒸剂,能防止某些昆虫、线虫的危害。在恒容密闭容器中,将CO和H2S混合加热并达到下列平衡: CO(g)+H2S(g)![]() COS(g)+H2(g) K=0.1,反应前CO的物质的量为10mol,平衡后CO物质的量为8mol,下列说法正确的是
COS(g)+H2(g) K=0.1,反应前CO的物质的量为10mol,平衡后CO物质的量为8mol,下列说法正确的是
A. 升高温度,H2S浓度增加,表明该反应是吸热反应 B. 通入CO后,正反应速率逐渐增大
C. CO的平衡转化率为80% D. 反应前H2S物质的量为7mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com