
【题目】在一密闭容器中,反应 a A(g)![]() b B(g)+c C(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的70%,以下不正确的是( )
b B(g)+c C(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的70%,以下不正确的是( )
A. 平衡向正反应方向移动了
B. 物质A的转化率减少了
C. 物质B的质量分数增加了
D. a<b+c
【答案】B
【解析】先假设体积增加一倍时若平衡未移动,B的浓度应为原来的50%,实际平衡时B的浓度是原来的70%,比假设大,说明平衡向生成B的方向移动,即减小压强平衡向正反应方向移动,则a<b+c,
A、假设体积增加一倍时若平衡未移动,B的浓度应为原来的50%,实际平衡时B的浓度是原来的70%,大于原来的50%,说明平衡向生成B的方向移动,即向正反应移动,故A正确;
B、根据A的判断,平衡向正反应移动,A的转化率增大,故B错误;
C、平衡向正反应移动,B的质量增大,混合气体的总质量不变,故物质B的质量分数增大,故C正确;
D、根据A的判断,平衡向生成B的方向移动,则a<b+c,故D正确;


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】某固定体积的密闭容器中,加入—定量的A达化学平衡: aA(g)![]() B(g)+c(g),在温度不变的条件下,再充入一定量的A物质,重新达到平衡时,下列判断中正确的是
B(g)+c(g),在温度不变的条件下,再充入一定量的A物质,重新达到平衡时,下列判断中正确的是
A. 若a=b+c时,B的物质的量分数变大 B. 若a=b+c时,B的物质的量分数不变
C. 若a>b+c时,A的转化率不变 D. 若a<b+c时,A的转化率变大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:在273K,101Kpa的条件下,某气体:①质量为m,②相对分子质量为M,③体积为V,④密度为ρ,⑤所含分子数为N(阿伏加德罗常数为NA),通过以上条件无法求出该气体物质的量
的是( )
A.①② B.③ C.⑤ D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机化合物的说法正确的是
A. 正丁烷与2-甲基丁烷互为同分异构体
B. 聚乙烯能使溴的四氯化碳溶液褪色,发生的反应是加成反应
C. 苯不能使酸性高锰酸钾溶液褪色,但在FeBr3存在下能与液溴发生取代反应
D. 除去乙酸乙酯中残留的乙酸,有效的处理方法是水洗后分液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】体积相同、pH相同的HCl溶液和CH3COOH溶液,与NaOH溶液中和时两者消耗NaOH的物质的量
A. 相同 B. 中和HCl的多
C. 中和CH3COOH的多 D. 无法比较
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某N2H4(肼或联氨)燃料电池(产生稳定、无污染的物质)原理如图1所示。
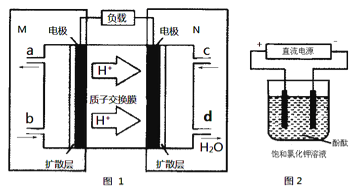
①M区发生的电极反应式为___________。
②用上述电池做电源,用图2装置电解饱和氯化钾溶液(电极均为惰性电极),设饱和氯化钾溶液体积为500mL,当溶液的pH值变为13时(在常温下测定),若该燃料电池的能量利用率为80%,则需消耗N2H4的质量为__________g(假设溶液电解前后体积不变)。
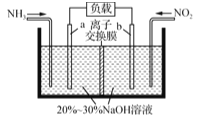
(2)①利用反应NO2+NH2―→N2+H2O(未配平)消除NO2的简易装置如图所示。电极b的电极反应式为______________;消耗标准状况下4.48 L NH3时,被消除的NO2的物质的量为________mol。
②合成氨的原料气需脱硫处理。一种脱硫方法是:先用Na2CO3溶液吸收H2S生成NaHS;NaHS再与NaVO3反应生成S、Na2V4O9和物质X。NaHS再与NaVO3反应的化学方程式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组用0.50 mol·L-1NaOH溶液和0.50 mol·L-1硫酸溶液进行中和热的测定。
Ⅰ.配制0.50 mol·L-1NaOH溶液
(1)若实验中大约要使用245mLNaOH溶液,至少需要称量NaOH固体 g。
(2)从下图中选择称量NaOH固体所需要的仪器是(填字母): 。
名称 | 托盘天平 (带砝码) | 小烧杯 | 坩埚钳 | 玻璃棒 | 药匙 | 量筒 |
仪器 |
|
|
|
|
|
|
序号 | a | b | c | d | e | f |
Ⅱ.测定稀硫酸和稀氢氧化钠中和热的实验装置如图所示。
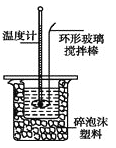
(1)不能用铜丝搅拌棒代替环形玻璃搅拌棒的理由是 。
(2)在操作正确的前提下,提高中和热测定准确性的关键是_____________。大烧杯如不盖硬纸板,求得的中和热数值将 (填“偏大”、“偏小”或“无影响”)。结合日常生活实际该实验在 中(家用产品)效果更好。
(3)写出该反应中和热的热化学方程式:(中和热为57.3 kJ·mol-1) 。
(4)取50 mLNaOH溶液和30 mL硫酸溶液进行实验,实验数据如下表。
试验次数 | 起始温度t1/℃ | 终止温度 t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 29.6 | |
2 | 27.0 | 27.4 | 27.2 | 31.2 | |
3 | 25.9 | 25.9 | 25.9 | 29.8 | |
4 | 26.4 | 26.2 | 26.3 | 30.4 | |
①表中的温度差平均值为 ℃。
②近似认为0.50 mol·L-1 NaOH溶液和0.50 mol·L-1硫酸溶液的密度都是1 g·cm-3,中和后生成溶液的比热容c = 4.18 J·(g·℃)-1。则中和热ΔH= (取小数点后一位)。
③上述实验数值结果与57.3 kJ·mol-1有偏差,产生偏差的原因可能是(填字母) 。
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
④实验中改用60mL0.5mol/L盐酸跟50mL0.55 mol·L-1氢氧化钠进行反应,与上述实验相比,所放出的热量 (填相等或不相等,下同),所求的中和热无偏差时 简述理由 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com