
【题目】维生素C(VitaminC)又名抗坏血酸,具有酸性和强还原性,也是一种常见的食品添加剂,其结构如图。下列有关说法中正确的是
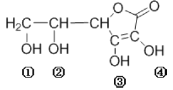
A.维生素C的分子式为C5H8O6
B.维生素C的酸性可能是③、④两个羟基引起的
C.维生素C中含有醚键
D.维生素C与足量的金属钠反应产生氢气的物质的量是维生素C的4倍
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】实验室用乙醇、浓硫酸和溴化钠反应来制备溴乙烷,其反应原理和实验的装置如下(反应需要加热,图中省去了加热装置):

H2SO4(浓)+NaBr ![]() NaHSO4+HBr↑
NaHSO4+HBr↑
CH3CH2OH+HBr![]() CH3CH2Br+H2O。有关数据见下表:
CH3CH2Br+H2O。有关数据见下表:
乙醇 | 溴乙烷 | 溴 | |
状态 | 无色液体 | 无色液体 | 深红色液体 |
密度/(g·cm-3) | 0.79 | 1.44 | 3.1 |
沸点/℃ | 78.5 | 38.4 | 59 |
(1)A装置的名称是______________。
(2)实验中用滴液漏斗代替分液漏斗的优点为_______________________。
(3)给A加热温度过高或浓硫酸的浓度过大,均会使C中收集到的粗产品呈橙色,原因是A中发生了副反应,写出此反应的化学方程式________________________。
(4)给A加热的目的是________________________,F接橡皮管导入稀NaOH溶液,其目的主要是___________________。
(5)图中C中的导管E的末端须在水面以下,其目的是______________________。
(6)粗产品洗涤、分液后,再经过蒸馏水洗涤、分液,然后加入少量的无水硫酸镁固体,静置片刻后过滤,再将所得滤液进行蒸馏,收集到的馏分约10.0 g。从乙醇的角度考虑,本实验所得溴乙烷的产率是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】B. [实验化学]
乙酰苯胺具有退热镇痛作用,是较早使用的解热镇痛药,有“退热冰”之称。其制备原理如下:

已知:
①苯胺易被氧化;
②乙酰苯胺、苯胺和醋酸的部分物理性质如下表:
物质 | 熔点 | 沸点 | 溶解度(20 ℃) |
乙酰苯胺 | 114.3℃ | 305℃ | 0.46 |
苯胺 | -6℃ | 184.4℃ | 3.4 |
醋酸 | 16.6℃ | 118℃ | 易溶 |
实验步骤如下:
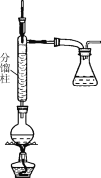
步骤1:在50 mL圆底烧瓶中,加入5 mL苯胺、7.5 mL冰醋酸及少许锌粉,依照如图装置组装仪器。
步骤2:控制温度计示数约105 ℃,小火加热回流1 h。
步骤3:趁热将反应混合物倒入盛有100 mL冷水的烧杯中,冷却后抽滤,洗涤,得到粗产品。
(1)步骤1中加入锌粉的作用是________。
(2)步骤2中控制温度计示数约105℃的原因是________。
(3)步骤3中趁热将混合物倒入盛有冷水的烧杯中,“趁热”的原因是__________________。抽滤装置所包含的仪器除减压系统外,还有________、________(填仪器名称)。
(4)步骤3得到的粗产品需进一步提纯,该提纯方法是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列问题:
(1)1 mol CO2中含有的σ键数目为________,π键数目为________。
(2)已知CO和CN-与N2结构相似,CO分子内σ键与π键个数之比为________。CH2=CHCN分子中σ键与π键数目之比为________。
(3)肼(N2H4)分子可视为NH3分子中的—个氢原子被-NH2(氨基)取代形成的另一种氮的氢化物。肼可用作火箭燃料,燃烧时发生的反应:N2O4(l)+2N2H4(l)===3N2(g)+4H2O(g) ΔH=-1 038.7 kJ·mol-1若该反应中有4 mol N—H键断裂,则形成的π键有________mol。
(4)Co 基态原子核外电子排布式为____________;
基态Ge原子的核外电子排布式为____________;
Zn2+的价电子轨道表示式为_______________;
Co3+核外电子未成对电子数为__________________。
(5)CH4、NH3、H2O、HF分子中共价键的极性由强到弱的顺序是_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】精炼铜工业中阳极泥的综合利用具有重要意义。一种从铜阳极泥(主要含有铜、银、金、少量的镍)中分离提取多种金属元素的工艺流程如下:

已知:ⅰ分金液中含金离子主要成分为[AuCl4]-;分金渣的主要成分为AgCl;
ⅱ分银液中含银离子主要成分为[Ag(SO3)2]3-,且存在[Ag(SO3)2]3—![]() Ag++2SO
Ag++2SO![]()
ⅲ“分铜”时各元素的浸出率如下表所示。

(1)由表中数据可知,Ni的金属性比Cu______。分铜渣中银元素的存在形式为(用化学用语表示)______。“分铜”时,如果反应温度过高,会有明显的放出气体现象,原因是_______。
(2)“分金”时,单质金发生反应的离子方程式为________。
(3)Na2SO3溶液中含硫微粒物质的量分数与pH的关系如图所示。

“沉银”时,需加入硫酸调节溶液的pH=4,分析能够析出AgCl的原因为_______。调节溶液的pH不能过低,理由为______(用离子方程式表示)。
(4)已知Ksp[Ag2SO4]=1.4×10-5,沉银时为了保证不析出Ag2SO4,应如何控制溶液中SO42—浓度(假定溶液中Ag+浓度为0.1mol/L)。________。
(5)工业上,用镍为阳极,电解0.1 mol/L NiCl2溶液与一定量NH4Cl组成的混合溶液,可得高纯度的球形超细镍粉。当其他条件一定时,NH4Cl的浓度对阴极电流效率及镍的成粉率的影响如图所示:
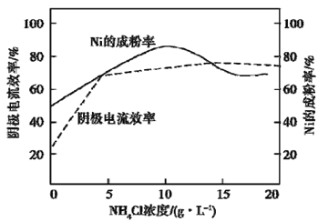
为获得髙纯度的球形超细镍粉,NH4Cl溶液的浓度最好控制为_______g/L,当NH4Cl溶液的浓度大于15g/L时,阴极有无色无味气体生成,导致阴极电流效率降低,该气体为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.据报道,我国在南海北部神狐海域进行的可燃冰(甲烷的水合物)试采获得成功。甲烷是一种重要的化工原料。
(1)甲烷重整是提高甲烷利用率的重要方式,除部分氧化外还有以下两种:
水蒸气重整:CH4(g)+H2O(g) ![]() CO(g)+3H2(g) ΔH1=+205.9 kJ·mol-1 ①
CO(g)+3H2(g) ΔH1=+205.9 kJ·mol-1 ①
CO(g)+H2O(g) ![]() CO2(g)+H2(g) ΔH2=-41.2 kJ·mol-1 ②
CO2(g)+H2(g) ΔH2=-41.2 kJ·mol-1 ②
二氧化碳重整:CH4(g)+CO2(g) ![]() 2CO(g)+2H2(g) ΔH3 ③
2CO(g)+2H2(g) ΔH3 ③
则反应①自发进行的条件是______________,ΔH3=______________kJ·mol-1。
Ⅱ.氮的固定一直是科学家研究的重要课题,合成氨则是人工固氮比较成熟的技术,其原理为N2 (g)+3H2 (g) ![]() 2NH3(g)。
2NH3(g)。
(2)在不同温度、压强和相同催化剂条件下,初始N2、H2 分别为0.1 mol、0.3 mol时,平衡后混合物中氨的体积分数(φ)如下图所示。

①其中,p1、p2 和p3 由大到小的顺序是______________________________,其原因是__________________________________________________________________。
②若分别用vA(N2)和vB(N2)表示从反应开始至达平衡状态A、B时的化学反应速率,则vA(N2)________vB(N2)(填“>”“<”或“=”)。
③若在250 ℃、p1 为105 Pa条件下,反应达到平衡时容器的体积为1 L,则该条件下B点N2 的分压p(N2)为_____________________Pa (分压=总压×物质的量分数,保留一位小数)。
Ⅲ.以连二硫酸根(S2O![]() )为媒介,使用间接电化学法也可处理燃煤烟气中的NO,装置如图所示:
)为媒介,使用间接电化学法也可处理燃煤烟气中的NO,装置如图所示:

(3)①阴极区的电极反应式为_________________________________。
②NO吸收转化后的主要产物为NH![]() ,若通电时电路中转移了0.3 mol e-,则此通电过程中理论上吸收的NO在标准状况下的体积为________mL。
,若通电时电路中转移了0.3 mol e-,则此通电过程中理论上吸收的NO在标准状况下的体积为________mL。
Ⅳ、常温下,将a mol·L-1的醋酸与b mol·L-1Ba(OH)2 溶液等体积混合,充分反应后,溶液中存在2c(Ba2+)=c(CH3COO-),则该混合溶液中醋酸的电离常数Ka=___________(用含a和b的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式中,正确的是 ( )
A. 稀硫酸滴在铁片上:2Fe+6H+===2Fe3++3H2↑
B. 碳酸氢钠溶液与稀盐酸混合:HCO3-+H+=H2O+CO2↑
C. 硫酸铜溶液与氢氧化钠溶液混合:CuSO4+2OH-===Cu(OH)2↓+![]()
D. 硝酸银溶液与氯化钠溶液混合:AgNO3+Cl-===AgCl↓+![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠(NaClO2)是一种重要的消毒剂,可用ClO2为原料制取。某化学兴趣小组同学展开对漂白剂亚氯酸钠(NaClO2)的研究。
已知:饱和NaClO2溶液在温度低于38 ℃时析出的晶体是NaClO2·3H2O,高于38 ℃时析出的晶体是NaClO2,高于60 ℃时 NaClO2分解成NaClO3和NaCl。Ba(ClO2)2可溶于水。
利用图所示装置进行实验。
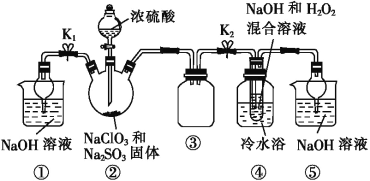
(1)装置①的作用是___________________,装置③的作用是________________。
(2)装置②中制备ClO2的化学方程式为___________________________;装置④中反应生成NaClO2的化学方程式为_____________________。
(3)从装置④反应后的溶液中获得NaClO2晶体的操作步骤为:①减压,55 ℃蒸发结晶;②趁热过滤;③__________________;④低于60 ℃干燥,得到成品。如果撤去④中的冷水浴,可能导致产品中混有的杂质是______________。
(4)设计实验检验所得NaClO2晶体是否含有杂质Na2SO4,操作与现象是取少量晶体溶于蒸馏水,__________________________________________________________。
(5)为了测定NaClO2粗品的纯度,取10.0 g上述初产品溶于水配成1 L溶液,取出10 mL溶液于锥形瓶中,再加入足量酸化的KI溶液,充分反应后(NaClO2被还原为Cl-,杂质不参加反应),加入2~3滴淀粉溶液,用0.20 mol·L-1的Na2S2O3标准液滴定,重复2次,平均消耗Na2S2O3溶液20.00 mL,计算得NaClO2粗品的纯度为_____。(提示:2Na2S2O3+I2=Na2S4O6+2NaI)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铵态氮肥和草木灰混合会降低肥效的原因是____________________,CH3COO-- 和NH4+、CO32--和NH4+在溶液中都是相互__________(促进或者抑制)的双水解,但是水解程度不大,可以大量共存。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com