
【题目】Ⅰ.据报道,我国在南海北部神狐海域进行的可燃冰(甲烷的水合物)试采获得成功。甲烷是一种重要的化工原料。
(1)甲烷重整是提高甲烷利用率的重要方式,除部分氧化外还有以下两种:
水蒸气重整:CH4(g)+H2O(g) ![]() CO(g)+3H2(g) ΔH1=+205.9 kJ·mol-1 ①
CO(g)+3H2(g) ΔH1=+205.9 kJ·mol-1 ①
CO(g)+H2O(g) ![]() CO2(g)+H2(g) ΔH2=-41.2 kJ·mol-1 ②
CO2(g)+H2(g) ΔH2=-41.2 kJ·mol-1 ②
二氧化碳重整:CH4(g)+CO2(g) ![]() 2CO(g)+2H2(g) ΔH3 ③
2CO(g)+2H2(g) ΔH3 ③
则反应①自发进行的条件是______________,ΔH3=______________kJ·mol-1。
Ⅱ.氮的固定一直是科学家研究的重要课题,合成氨则是人工固氮比较成熟的技术,其原理为N2 (g)+3H2 (g) ![]() 2NH3(g)。
2NH3(g)。
(2)在不同温度、压强和相同催化剂条件下,初始N2、H2 分别为0.1 mol、0.3 mol时,平衡后混合物中氨的体积分数(φ)如下图所示。

①其中,p1、p2 和p3 由大到小的顺序是______________________________,其原因是__________________________________________________________________。
②若分别用vA(N2)和vB(N2)表示从反应开始至达平衡状态A、B时的化学反应速率,则vA(N2)________vB(N2)(填“>”“<”或“=”)。
③若在250 ℃、p1 为105 Pa条件下,反应达到平衡时容器的体积为1 L,则该条件下B点N2 的分压p(N2)为_____________________Pa (分压=总压×物质的量分数,保留一位小数)。
Ⅲ.以连二硫酸根(S2O![]() )为媒介,使用间接电化学法也可处理燃煤烟气中的NO,装置如图所示:
)为媒介,使用间接电化学法也可处理燃煤烟气中的NO,装置如图所示:

(3)①阴极区的电极反应式为_________________________________。
②NO吸收转化后的主要产物为NH![]() ,若通电时电路中转移了0.3 mol e-,则此通电过程中理论上吸收的NO在标准状况下的体积为________mL。
,若通电时电路中转移了0.3 mol e-,则此通电过程中理论上吸收的NO在标准状况下的体积为________mL。
Ⅳ、常温下,将a mol·L-1的醋酸与b mol·L-1Ba(OH)2 溶液等体积混合,充分反应后,溶液中存在2c(Ba2+)=c(CH3COO-),则该混合溶液中醋酸的电离常数Ka=___________(用含a和b的代数式表示)。
【答案】高温 +247.1 p1>p2>p3 温度相同时,增大压强,化学平衡向正反应方向移动,故平衡混合物中氨的体积分数越大则对应压强越大 < 8.3×103 2SO32-+4H++2e-===S2O42-+2H2O 1 344 ![]()
【解析】
(1)根据![]() 判断反应①自发进行的条件;根据盖斯定律计算ΔH3;
判断反应①自发进行的条件;根据盖斯定律计算ΔH3;
(2) ①增大压强N2 (g)+3H2 (g) ![]() 2NH3(g)平衡正向移动,氨的体积分数增大;
2NH3(g)平衡正向移动,氨的体积分数增大;
②压强越大、温度越高,反应速率越快;
③利用“三段式”计算在250 ℃、p1 为105 Pa条件下,反应达到平衡时容器各物质的量;
(3)①阴极SO32-得电子发生还原反应生成S2O42-;
②根据得失电子守恒计算吸收NO的体积;
Ⅳ、醋酸电离平衡常数Ka=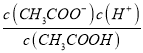 。
。
(1)该反应ΔH>0、ΔS>0, ![]() 能自发进行,所以在高温条件下反应①能自发进行;
能自发进行,所以在高温条件下反应①能自发进行;
CH4(g)+H2O(g) ![]() CO(g)+3H2(g) ΔH1=+205.9 kJ·mol-1 ①
CO(g)+3H2(g) ΔH1=+205.9 kJ·mol-1 ①
CO(g)+H2O(g) ![]() CO2(g)+H2(g) ΔH2=-41.2 kJ·mol-1 ②
CO2(g)+H2(g) ΔH2=-41.2 kJ·mol-1 ②
根据盖斯定律①-②得CH4(g)+CO2(g) ![]() 2CO(g)+2H2(g) ΔH3=ΔH1-ΔH2=+205.9 kJ·mol-1+41.2 kJ·mol-1=+247.1 kJ·mol-1;
2CO(g)+2H2(g) ΔH3=ΔH1-ΔH2=+205.9 kJ·mol-1+41.2 kJ·mol-1=+247.1 kJ·mol-1;
(2) ①温度相同时,增大压强,N2 (g)+3H2 (g) ![]() 2NH3(g)平衡正向移动,所以压强越大氨的体积分数增大,p1、p2 和p3 由大到小的顺序是p1>p2>p3;
2NH3(g)平衡正向移动,所以压强越大氨的体积分数增大,p1、p2 和p3 由大到小的顺序是p1>p2>p3;
②压强越大、温度越高,反应速率越快;A点压强、温度都低于B,所以vA(N2) <vB(N2);
③
N2 (g)+3H2 (g) ![]() 2NH3(g)
2NH3(g)
开始 0.1 0.3 0
转化 x 3x 2x
平衡 0.1-x 0.3-3x 2x
![]()
x=0.08mol
平衡时N2 、H2 、NH3的物质的量分别是0.02、0.06、0.16;N2 的分压p(N2)为![]() 8.3×103;
8.3×103;
(3)①阴极SO32-得电子发生还原反应生成S2O42-,阴极反应式是2SO32-+4H++2e-===S2O42-+2H2O;
②NO吸收转化后的主要产物为NH![]() ,吸收1molNO转移5mol电子,设吸收标准状况下NO的体积为xL
,吸收1molNO转移5mol电子,设吸收标准状况下NO的体积为xL
![]()
span>X=1.344L=1344mL;
Ⅳ、将a mol·L-1的醋酸与b mol·L-1Ba(OH)2 溶液等体积混合,根据物料守恒c(Ba2+)=![]() ,c(CH3COO-)+ c(CH3COOH) =
,c(CH3COO-)+ c(CH3COOH) =![]() ,2c(Ba2+)=c(CH3COO-),则c(CH3COO-)=b,c(CH3COOH) =
,2c(Ba2+)=c(CH3COO-),则c(CH3COO-)=b,c(CH3COOH) =![]() ,根据电荷守恒和2c(Ba2+)=c(CH3COO-)可知c(H+)= c(OH-)=10-7,Ka=
,根据电荷守恒和2c(Ba2+)=c(CH3COO-)可知c(H+)= c(OH-)=10-7,Ka=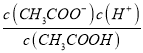 =
=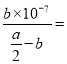
![]() 。
。


 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案科目:高中化学 来源: 题型:
【题目】有机物分子中原子间(或原子与原子团间)的相互影响会导致物质化学性质得不同。下列事实不能说明上述观点的是( )
A. 甲苯能使酸性KMn04溶液褪色,甲基环己烷不能使酸性KMn04溶液褪色
B. 乙烯能与溴水发生加成反应,而乙烷不能与溴水发生加成反应
C. 苯与浓硝酸反应生成硝基苯,而甲苯与浓硝酸反应生成三硝基甲苯
D. 苯酚( )可以与NaOH反应,而乙醇(CH3CH2OH)不能与NaOH反应
)可以与NaOH反应,而乙醇(CH3CH2OH)不能与NaOH反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)高铁酸钾![]() 不仅是一种理想的水处理剂,而且高铁电池的研制也在进行中。总反应式为
不仅是一种理想的水处理剂,而且高铁电池的研制也在进行中。总反应式为![]()
![]()
![]() ,如图是高铁电池的模拟实验装置:
,如图是高铁电池的模拟实验装置:

①该电池盐桥中盛有饱和![]() 溶液,此盐桥中氯离子向______(填“左”或“右”)移动。
溶液,此盐桥中氯离子向______(填“左”或“右”)移动。
②该电池放电时正极的电极反应式为______;充电时每转移0.3mol电子,有______mol![]() 生成,正极附近溶液的碱性______(填“增强”,“不变”或“减弱”)。
生成,正极附近溶液的碱性______(填“增强”,“不变”或“减弱”)。

③上图为高铁电池和常用的高能碱性电池的放电曲线,由此可得出高铁电池的优点有_________________。
(2)“![]() ”电池可将
”电池可将![]() 变废为宝。我国科研人员研制出的可充电“
变废为宝。我国科研人员研制出的可充电“![]() ”电池,以钠箔和多壁碳纳米管(MWCNT)为电极材料,总反应为
”电池,以钠箔和多壁碳纳米管(MWCNT)为电极材料,总反应为![]()
![]()
![]() 。放电时该电池“吸入”
。放电时该电池“吸入”![]() ,其工作原理如图所示:
,其工作原理如图所示:

①充电时,正极的电极反应式为________________________________。
②放电时,若生成的![]() 和
和![]() 全部沉积在电极表面,当转移0.2mol
全部沉积在电极表面,当转移0.2mol![]() 时,两极的质量差为______。
时,两极的质量差为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中,溶质的物质的量浓度不是1mol·L-1的是
A.将80gSO3溶于水并配成1L的溶液
B.10gNaOH固体溶解在水中配成250mL溶液
C.将0.5mol·L-1的NaNO3溶液100mL加热蒸发掉50g水的溶液
D.标准状况下,将22.4L氯化氢气体溶于水配成1L溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A.碳酸钙与醋酸反应:CO32-+2CH3COOH=CO2↑+H2O+2CH3COO-
B.在NaHCO3溶液中加入过量Ba(OH)2溶液:HCO3-+Ba2++OH-=BaCO3↓+H2O
C.用氨水吸收少量的二氧化硫:NH3·H2O+SO2=NH4++HSO3-
D.纯碱溶液中滴加少量硫酸,边加边振荡:2H++CO32-=H2O+CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化钙(Ca3N2)是一种重要的化学试剂。某化学兴趣小组拟制备氮化钙并测定产品纯度。
已知:①氮化钙极易与水反应;②实验室在加热条件下用饱和NaNO2溶液和饱和(NH4)2SO4溶液混合制备N2;③焦性没食子酸溶液用于吸收少量O2。
I.制备氮化钙。
他们选择下列装置设计实验(装置可重复使用):

(1)实验室将钙保存在________中(填物质名称)。氮化钙中所含化学键类型是_________。
(2)气体从左至右,装置连接顺序为____________________________。(填代号)
(3)写出A中发生反应的化学方程式:______________________________。
(4)用化学方法检验氮化钙(Ca3N2)产品中是否混有Ca,设计实验方案:________。
Ⅱ.测定产品纯度。
利用如图装置测定氮化钙产品纯度(杂质不产生气体,氨气不溶于煤油)。

(5)当产品与蒸馏水完全反应后,冷却至室温、调平液面、读数。调平液面的操作是___________________________________。
(6)取产品质量为w g,开始量气管读数为V1 mL,最终量气管读数为V2 mL(折合成标准状况),则该样品纯度为________________________(用代数式表示)。如果开始仰视刻度线,终点时俯视刻度线,则测得结果________(填“偏高”“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微型银-锌电池可用作电子仪器的电源,其电极分别是![]() 和
和![]() ,电解质为
,电解质为![]() 溶液,电池总反应为
溶液,电池总反应为![]() ,下列说法正确的是( )
,下列说法正确的是( )
A. 电池工作过程中,![]() 溶液浓度降低
溶液浓度降低
B. 电池工作过程中,电解液中![]() 向负极迁移
向负极迁移
C. 负极发生反应![]()
D. 正极发生反应![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】干燥的二氧化碳和氮气反应可生成氨基甲酸铵固体,化学方程式为:![]()
![]() ,在四氯化碳中通入二氧化碳和氨制备氨基甲酸铵的实验装置如下图所示,回答下列问题:
,在四氯化碳中通入二氧化碳和氨制备氨基甲酸铵的实验装置如下图所示,回答下列问题:

(1)装置1用来制备二氧化碳气体:将块状石灰石放置在试管中的带孔塑料板上,漏斗中所加试剂为____;装置2中所加试剂为____;
(2)装置4中试剂为固体NH4Cl和Ca(OH)2,发生反应的化学方程式为________;试管口不能向上倾斜的原因是__________。装置3中试剂为KOH,其作用为______________。
(3)反应时三颈瓶需用冷水浴冷却,其目的是_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列装置或操作能达到目的的是
A. 装置用于测定生成氢气的速率
装置用于测定生成氢气的速率
B. 装置依据单位时间内颜色变化来比较浓度对反应速率的影响
装置依据单位时间内颜色变化来比较浓度对反应速率的影响
C. 装置依据 U 型管两边液面的高低判断钠和水反应的热效应
装置依据 U 型管两边液面的高低判断钠和水反应的热效应
D. 装置依据出现浑浊的快慢比较温度对反应速率的影响
装置依据出现浑浊的快慢比较温度对反应速率的影响
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com