
| A、正极反应式为:O2+2H2O+4e-═4OH- |
| B、工作一段时间后,电解液中KOH的物质的量不变 |
| C、该燃料电池的总反应方程式为:2H2+O2═2H2O |
| D、用该电池电解CuCl2溶液,产生2.24 L Cl2(标准状况)时,有0.1 mol电子转移 |


 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:
| A、①③② | B、③②① |
| C、②③① | D、②①③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、至少有4个碳原子在一条直线上 |
| B、6个碳原子不可能都在一条直线上 |
| C、6个碳原子有可能都在同一平面上 |
| D、6个碳原子不可能都在同一平面上 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、混合烧碱和小苏打溶液HCO3-+H+═H2O+CO2↑ | ||||
| B、氢氧化镁中加入稀硫酸H++OH-═H2O | ||||
| C、氯化铝溶液中加入氨水Al3++3OH-═Al(OH)3↓ | ||||
D、加热碳酸氢钙溶液Ca2++2HCO3-
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温常压下,1.06g Na2CO3含有的Na+离子数为0.02 NA |
| B、标准状况下,22.4LH2O含有的分子数为1 NA |
| C、通常状况下,1 NA 个CO2分子占有的体积为22.4L |
| D、物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl- 个数为1 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CuCl2═Cu2++Cl2- |
| B、Al2(SO4)3=2Al3++3SO42- |
| C、Fe2(SO4)3═2Fe2++3SO42- |
| D、Ba(NO3)2═Ba2++2(NO3)2- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、碳酸氢钙溶液中加入过量的NaOH溶液:Ca2++HCO3-+OH-=CaCO3↓+H2O |
| B、NaHSO4溶液与Ba(OH)2溶液混合后显酸性:Ba2++OH-+H++SO42-=BaSO4↓+H2O |
| C、NaHCO3溶液中加入足量NaHSO4溶液:2H++CO32-═CO2↑+H2O |
| D、NaHCO3溶液中加入过量的Ba(OH)2溶液:HCO3-+Ba2++OH-=BaCO3↓+2H2O. |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H2SO4和NaHSO4都属于酸 |
| B、K2CO3和K2S都属于盐 |
| C、KOH和Na2CO3都属于碱 |
| D、Na2O和Na2SiO3都属于氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
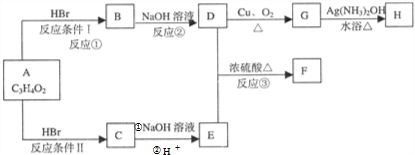
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com