
【题目】如图①、②、③、④、⑤五组仪器(可重复使用),选择合适的装置和药品能完成的实验是( )
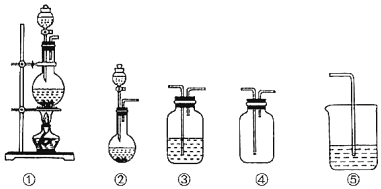
选项 | 实验目的 | 实验装置 | 实验药品 |
A | 制备并收集HCl气体 | ①③④ | 浓盐酸、浓硫酸、水 |
B | 比较氯气和溴的氧化性强弱 | ①③⑤ | MnO2、浓盐酸、饱和食盐水、溴化钾溶液、氢氧化钠溶液 |
C | 探究乙烯的加成反应 | ①③ | 无水乙醇、浓硫酸、溴的四氯化碳溶液 |
D | 探究二氧化硫的还原性 | ②③⑤ | 亚硫酸钠、30%的硝酸、溴水、氢氧化钠溶液 |
A.AB.BC.CD.D
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】工业上用CO与H2合成甲醇,CO(g)+2H2(s)![]() CH3OH(g) △H=—90.8kJ/mol。300℃时,在容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下
CH3OH(g) △H=—90.8kJ/mol。300℃时,在容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下
容量 | 甲 | 乙 | 丙 | |
反应物投入量 | 1 molCO、2molH2 | 1mol CH3OH | 2mol CH3OH | |
平衡时数据 | CH3OH的浓度(mol/L) | c1 | c2 | c3 |
反应的能量变化 | a kJ | b kJ | c kJ | |
体系压强(Pa) | P1 | P2 | P3 | |
反应物转化率 | a1 | a2 | a3 | |
下列说法正确的是
A.2c1>c3B.a+b<90.8C.2P2<P3D.a1+a3<1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁粉与水蒸气反应的装置如图所示,有关该反应的说法正确的是( )
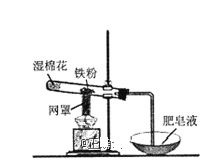
A.该反应属于复分解反应
B.网罩的作用是集中火焰,提高温度
C.湿棉花的作用是给试管降温,防止炸裂
D.铁与水蒸气在高温下的反应产物为Fe2O3和H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,将 0.4 mol A(g)和 0.2 mol B (g)充入 10 L 的恒容密闭容器发生反应:2A(g)+B(g)xC(g)(x是化学计量数),达平衡时测得 C(g) 的浓度为 0.016mol/L,B(g)的物质的量为0.12mol。下列说法中不正确的是
A.x=2
B.达平衡时A的转化率为40%
C.该温度下该反应的化学平衡常数是K=12
D.反应前容器内的压强与平衡后容器内的压强之比为15:13
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气是一种清洁能源,又是合成氨工业的重要原料.已知氢气有多种制取方法:
①活泼金属![]() 如钠、钾
如钠、钾![]() 直接跟水反应;
直接跟水反应;
②金属![]() 如锌或铁或铝
如锌或铁或铝![]() 跟稀盐酸或稀硫酸反应;
跟稀盐酸或稀硫酸反应;
③电解水制氢气;
④由煤或焦炭跟水反应制取氢气:![]()
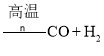 ;
;
⑤由天然气或重油制取氢气:![]()

![]() ;
;
(1)请你再补充一种制取氢气的方法,写出该反应的化学方程式 ______ .
(2)比较方法①和⑤: ______ g金属钠跟水反应与标准状况下![]()
![]() 跟水反应产生氢气的量相等.
跟水反应产生氢气的量相等.
(3)在甲、乙、丙3个容积均为2L的密闭容器中,于相同的温度下、使用相同的催化剂分别进行如下反应: 3H2(g)+N2(g) ![]() 2NH3(g),现按不同配比投入反应物,保持恒温、恒容,测得反应达到平衡时有关数据如下:
2NH3(g),现按不同配比投入反应物,保持恒温、恒容,测得反应达到平衡时有关数据如下:
容器 | 甲 | 乙 | 丙 |
反应物投入量 |
|
|
|
达到平衡的时间 |
| 5 | 8 |
| c |
| c |
|
|
|
|
混合气体密度 |
|
|
|
①分析表数据,下列关系正确的是 ______ ![]() 填写序号字母
填写序号字母![]() .
.
A.![]()
![]()
![]()
②在该温度下该反应的平衡常数![]() ______
______ ![]() 用含
用含![]() 的代数式表示
的代数式表示![]() .
.
(4)已知:![]() ;
;![]()
![]() ;
;![]()
则甲烷和![]() 反应生成
反应生成![]() 和
和![]() 的热化学方程式为 ______ .
的热化学方程式为 ______ .
(5)如图所示装置工作时均与![]() 有关.
有关.
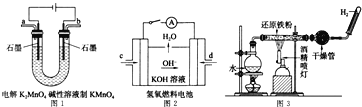
①图1所示装置中阳极的电极反应式为 ______ .
②图2所示装置中,通入![]() 的管口是 ______
的管口是 ______ ![]() 选填字母代号
选填字母代号![]() .
.
③某同学按图3所示装置进行实验,实验结束后,将玻璃管内固体物质冷却后,溶于稀硫酸,充分反应后,滴加KSCN溶液,溶液不变红,再滴入新制氯水,溶液变为红色.该同学据此得出结论:铁与水蒸气反应生成FeO和![]() 该结论 ______
该结论 ______ ![]() 填“严密”或“不严密”
填“严密”或“不严密”![]() ,你的理由是 ______
,你的理由是 ______ ![]() 用离子方程式表示
用离子方程式表示![]() .
.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以氨气、空气为主要原料制硝酸。
(1)氨气被氧气催化氧化生成NO的化学方程式是______。
(2)在密闭容器中进行反应![]() 该反应的反应速率
该反应的反应速率![]() 随时间
随时间![]() 变化的关系如图所示,若
变化的关系如图所示,若![]() 、
、![]() 时刻只改变一个条件,下列说法正确的是
时刻只改变一个条件,下列说法正确的是![]() 填选项序号
填选项序号![]() ______。
______。
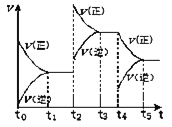
![]() 在
在![]() 时,可依据定容容器内气体的压强保持不变判断反应已达到平衡状态
时,可依据定容容器内气体的压强保持不变判断反应已达到平衡状态
![]() 在
在![]() 时,采取的措施可以是升高温度
时,采取的措施可以是升高温度
![]() 在
在![]() 时,可依据容器内气体的密度保持不变判断反应已达到平衡状态
时,可依据容器内气体的密度保持不变判断反应已达到平衡状态
![]() 在
在![]() 时,容器内
时,容器内![]() 的体积分数是整个过程中的最大值
的体积分数是整个过程中的最大值
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝酸厂常用以下方法处理尾气:
(1)碱液吸收法:用![]() 溶液吸收
溶液吸收![]() 生成
生成![]() ,若取
,若取![]() 和足量
和足量![]() 溶液完全反应时转移电子数为
溶液完全反应时转移电子数为![]() ,该反应的离子方程式是______。
,该反应的离子方程式是______。
(2)氨催化吸收法,原理是![]() 与
与![]() 反应生成无毒的物质。某同学采用如图装置和步骤模拟工业上氮的氧化物处理过程:
反应生成无毒的物质。某同学采用如图装置和步骤模拟工业上氮的氧化物处理过程:
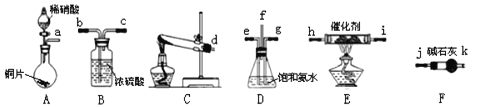
利用上述仪器,按如图流程图连接成模拟尾气处理装置:
![]()
①管口f接管口______。
②D装置的作用是______,用饱和氨水而不用纯水的目的是______。
③E装置中发生反应的化学方程式是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸是重要的化工原料,工业制取硫酸最重要的一步反应为:2SO2(g)+O2(g) ![]() 2SO3(g) △H< 0
2SO3(g) △H< 0
(1)为提高SO2的转化率,可通入过量O2,用平衡移动原理解释其原因:___________。
(2)某兴趣小组在实验室对该反应进行研究,部分实验数据和图像如下。
反应条件:催化剂、一定温度、容积10 L
实验 | 起始物质的量/mol | 平衡时SO3 物质的量/mol | ||
SO2 | O2 | SO3 | ||
ⅰ | 0.2 | 0.1 | 0 | 0.12 |
ⅱ | 0 | 0 | 0.2 | a |
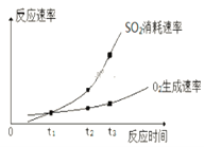
①实验ⅰ中SO2的转化率为______。
②a____0.12(填“>”、“=”或“<”)。
③t1、t2、t3中,达到化学平衡状态的是________。
④ t2到t3的变化是因为改变了一个反应条件,该条件可能是___________。
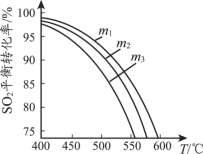
(3)将SO2和O2充入恒压密闭容器中,原料气中SO2 和O2的物质的量之比m(m=n(SO2)/n(O2))不同时,SO2的平衡转化率与温度(T)的关系如下图所示,则m1、m2、m3的大小顺序为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列描述中正确的是
A.CS2为V形的极性分子
B.ClO3-的空间构型为平面三角形
C.SF6中S原子和氟原子均满足最外层8电子稳定结构
D.SiF4和SO32-的中心原子均为sp3杂化,SiF4分子呈空间正四面体,SO32-呈三角锥形
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com