
【题目】工业上用CO与H2合成甲醇,CO(g)+2H2(s)![]() CH3OH(g) △H=—90.8kJ/mol。300℃时,在容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下
CH3OH(g) △H=—90.8kJ/mol。300℃时,在容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下
容量 | 甲 | 乙 | 丙 | |
反应物投入量 | 1 molCO、2molH2 | 1mol CH3OH | 2mol CH3OH | |
平衡时数据 | CH3OH的浓度(mol/L) | c1 | c2 | c3 |
反应的能量变化 | a kJ | b kJ | c kJ | |
体系压强(Pa) | P1 | P2 | P3 | |
反应物转化率 | a1 | a2 | a3 | |
下列说法正确的是
A.2c1>c3B.a+b<90.8C.2P2<P3D.a1+a3<1
【答案】D
【解析】
A.由于乙是从反应的逆反应方向开始,若认为1mol CH3OH的反应产生的,则消耗1 molCO、2molH2,所以与从反应的正反应方向开始的甲是等效平衡,c1=c2。对于丙,由于是加入2mol CH3OH,比乙物质的浓度大,若增大物质的浓度,平衡不发生移动,则平衡时CH3OH的浓度应该是c2的2倍,根据平衡移动原理:增大压强,平衡向气体体积减小的反应方向移动,即向正反应方向移动,所以c3>2c1,A错误;
B.由于甲、乙是从反应的正逆相反反应方向开始的,物质的转化率的和是100%,所以a+b=90.8,B错误;
C.假如增大物质的浓度平衡不发生移动,由于丙的物质是乙的二倍,则2P2=P3。而实质上,增大物质的浓度,即增大压强,平衡向气体体积减小的方向移动,是使气体的物质的量减小,所以P3<2P2,C错误;
D.由于甲、乙是等效平衡,是从相反方向开始的a1+a2=1。而丙则是由于增大生成物的浓度,即增大了体系的压强,平衡正向移动,所以a3< a2,所以a1+a3<1,D正确;
答案选D。


科目:高中化学 来源: 题型:
【题目】臭氧在烟气脱硝中的反应为2NO2(g)+O3(g)![]() N2O5(g)+O2(g)。若此反应在恒容密闭容器中进行,相关图像如下,其中对应分析结论正确的是( )
N2O5(g)+O2(g)。若此反应在恒容密闭容器中进行,相关图像如下,其中对应分析结论正确的是( )
A.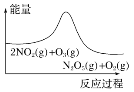 平衡后降温,NO2含量降低
平衡后降温,NO2含量降低
B.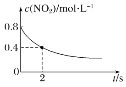 0~2 s内,υ(O3)=0.2 mol·L-1·s-1
0~2 s内,υ(O3)=0.2 mol·L-1·s-1
C.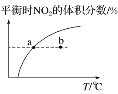 υ正:b点<a点,b点:υ逆<υ正
υ正:b点<a点,b点:υ逆<υ正
D.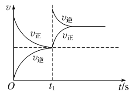 恒温,t1时再充入O3
恒温,t1时再充入O3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度为T时,向2VL的密闭容器中充入一定量的A和B,发生反应:![]() ;
;![]() ,容器中A、B、D的物质的量浓度随时间的变化如图所示。下列说法正确的是
,容器中A、B、D的物质的量浓度随时间的变化如图所示。下列说法正确的是
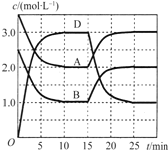
A.反应在前10min的平均反应速率![]()
B.反应至15min时,改变的条件是降低温度
C.若平衡时保持温度不变,压缩容器体积平衡向逆反应方向移动
D.该反应的平衡常数表达式
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向体积均为2 L的两个恒容密闭容器中分别充入1molSiHCl3,维持容器的温度分别为T1℃和T2℃不变,发生反应:2SiHCl3(g)![]() SiH2Cl2(g)+SiCl4(g) ΔH1=a kJ·mol1。反应过程中SiHCl3的转化率随时间的变化如图所示。下列说法正确的是
SiH2Cl2(g)+SiCl4(g) ΔH1=a kJ·mol1。反应过程中SiHCl3的转化率随时间的变化如图所示。下列说法正确的是
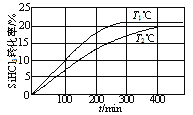
A.T1>T2
B.T1℃时,0~100min反应的平均速率v(SiHCl3)=0.001mol·(L·min)-1
C.T2℃时,反应的平衡常数:K=1/64
D.T2℃时,使用合适的催化剂,可使SiHCl3的平衡转化率与T1℃时相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在三个容积相同的恒容密闭容器中按不同方式投入反应物,发生反应2SO2(g)+ O2(g)![]() 2SO3(g)△H = -196.0 kJ.mol-1,测得反应的相关数据如下,下列说法正确的是( )
2SO3(g)△H = -196.0 kJ.mol-1,测得反应的相关数据如下,下列说法正确的是( )
容器1 | 容器2 | 容器3 | |
应温度T/K | 700 | 700 | 800 |
反应物投入量 | 2 mol SO2、1mol O2 | 4mol SO3 | 2 mol SO3 |
平衡v正(SO2)/molL-1S-1 | v1 | v2 | v3 |
平衡c(SO3)/molL-1 | c1 | c2 | c3 |
平衡体系总压强p/Pa | p1 | p2 | p3 |
反应能量变化 | 放出a KJ | 吸收b KJ | 吸收c KJ |
物质的平衡转化率α | α1(SO2) | α2(SO3) | α3(SO2) |
平衡常数K | K1 | K2 | K3 |
A. v1< v2,c2<2c1B. K1> K3,p2>2p3
C.v1< v3,α1(SO2 ) <α2(SO3 ) D. c2>2c3,α2(SO3 )+α3(SO2 )<1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.麦芽糖水解的产物互为同分异构体
B.甘氨酸与苯丙氨酸互为同系物
C.CH3CH2OOCCOOCH2CH3 的名称是乙二酸乙二酯
D.天然油脂大多是由混合甘油酯分子组成的混合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年8月13日中国科学家合成了首例缺陷诱导的晶态无机硼酸盐单一组分白光材料Ba2[Sn(OH)6][B(OH)4]2并获得了该化合物的LED器件,该研究结果有望为白光发射的设计和应用提供一个新的有效策略。
(1)基态Sn原子价电子排布式为_______,基态氧原子的价层电子排布式不能表示为2s22px22py2,因为这违背了_______原理(规则)。
(2)[B(OH)4]-中硼原子的杂化轨道类型为______,氧原子的价层电子对互斥模型是_____。[Sn(OH)6] 2-中,Sn与O之间的化学键不可能是_____。
a.π键 b.σ键 c.配位键 d.极性键
(3)氨硼烷(NH3BH3)被认为是最具潜力的新型储氢材料之一,分子中存在配位键,写出氨硼烷的结构式_______,并写出一种与氨硼烷互为等电子体的分子_______(填化学式)。
(4)已知硼酸(H3BO3)为一元弱酸,写出硼酸表现一元弱酸性的电离方程式________。
(5)碳酸钡、碳酸镁分解得到的金属氧化物中,熔点较高的是_______(填化学式),其原因是___________。
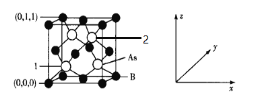
(6)超高热导率半导体材料——砷化硼(BAs)的晶胞结构如图所示,则2号砷原子的坐标为______。已知阿伏加德罗常数的值为NA,若晶胞中As原子到B原子最近距离为a pm,则该晶体的密度为______g·cm-3(列出含a、NA的计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯乙酸铜是合成优良催化剂、传感材料——纳米氧化铜的重要前驱体之一。下面是它的一种实验室合成路线:
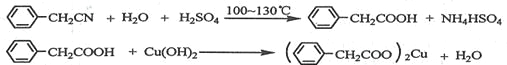
制备苯乙酸的装置示意图如下(加热和夹持装置等略):
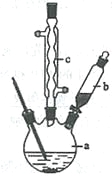
已知:苯乙酸的熔点为76.5 ℃,微溶于冷水,溶于乙醇。
回答下列问题:
(1)在250 mL三口瓶a中加入70 mL70%硫酸。配制此硫酸时,加入蒸馏水与浓硫酸的先后顺序是
__________________________。
(2)将a中的溶液加热至100 ℃,缓缓滴加40 g苯乙腈到硫酸溶液中,然后升温至130 ℃继续反应。在装置中,仪器b的作用是_____________________;仪器c的名称是______________,其作用是___________________________________________。
反应结束后加适量冷水,再分离出苯乙酸粗品。加人冷水的目的是____________。下列仪器中可用于分离苯乙酸粗品的是________________(填标号)。
A.分液漏斗 | B.漏斗 | C.烧杯 | D.直形冷凝管E.玻璃棒 |
(3)提纯粗苯乙酸的方法是_____________,最终得到44 g纯品,则苯乙酸的产率是________。
(4)用CuCl2 2H2O和NaOH溶液制备适量Cu(OH)2沉淀,并多次用蒸馏水洗涤沉淀,判断沉淀洗干净的实验操作和现象是____________________________________________。
(5)将苯乙酸加人到乙醇与水的混合溶剂中,充分溶解后,加入Cu(OH)2搅拌30min,过滤,滤液静置一段时间,析出苯乙酸铜晶体,混合溶剂中乙醇的作用是___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图①、②、③、④、⑤五组仪器(可重复使用),选择合适的装置和药品能完成的实验是( )
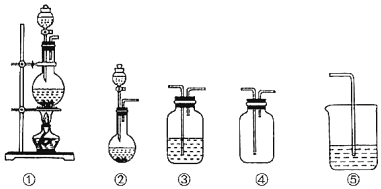
选项 | 实验目的 | 实验装置 | 实验药品 |
A | 制备并收集HCl气体 | ①③④ | 浓盐酸、浓硫酸、水 |
B | 比较氯气和溴的氧化性强弱 | ①③⑤ | MnO2、浓盐酸、饱和食盐水、溴化钾溶液、氢氧化钠溶液 |
C | 探究乙烯的加成反应 | ①③ | 无水乙醇、浓硫酸、溴的四氯化碳溶液 |
D | 探究二氧化硫的还原性 | ②③⑤ | 亚硫酸钠、30%的硝酸、溴水、氢氧化钠溶液 |
A.AB.BC.CD.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com