
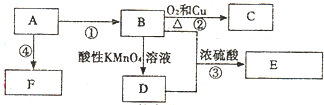
 ,据此解答.
,据此解答. ,
,| Cu |
| △ |
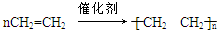 ,
,| Cu |
| △ |
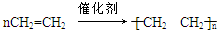 .
.


科目:高中化学 来源: 题型:
| A、锥形瓶用待测溶液润洗 |
| B、碱式滴定管可不用碱液润洗 |
| C、盐酸滴定氢氧化钠溶液时可以用甲基橙作指示剂 |
| D、滴定操作时,眼睛应注视滴定管中液面的变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、X、M两种元素形成的化合物的中一定含有离子键,不可能含有共价键 |
| B、由于W、Z、M元素的氢化物的相对分子质量依次减小,所以其沸点依次降低 |
| C、元素Y、Z、W、M的电负性高低顺序为:M>W>Z>Y |
| D、化合物ZW2的分子空间构型为直线形 |
查看答案和解析>>
科目:高中化学 来源: 题型:
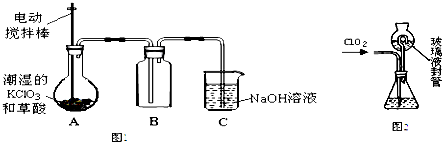
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物 质 | SiCl4 | BCl3 | AlCl3 | FeCl3 | PCl5 |
| 沸点/℃ | 57.7 | 12.8 | - | 315 | - |
| 熔点/℃ | -70.0 | -107.2 | - | - | - |
| 升华温度/℃ | - | - | 180 | 300 | 162 |

查看答案和解析>>
科目:高中化学 来源: 题型:
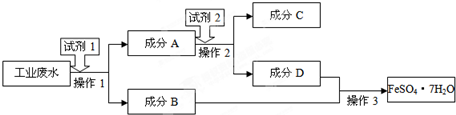
查看答案和解析>>
科目:高中化学 来源: 题型:
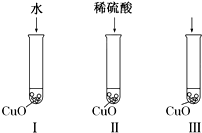 氧化铜是一种黑色固体,可溶于稀硫酸.某化学兴趣小组为探究稀硫酸中哪种粒子能使氧化铜溶解,该小组同学提出如下假设:
氧化铜是一种黑色固体,可溶于稀硫酸.某化学兴趣小组为探究稀硫酸中哪种粒子能使氧化铜溶解,该小组同学提出如下假设:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com