
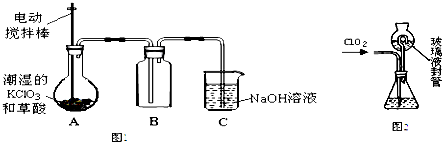
| 1 |
| 5 |
| 1 |
| 5 |


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:
| A、将100g水倒入100g 98% 硫酸溶液中配制成49% 的硫酸溶液 |
| B、给试管里的液体加热时,液体体积不得超过试管容积的1/3 |
| C、使用胶头滴管时,应将滴管尖嘴伸进试管内,以免液体外流 |
| D、不小心将浓硫酸洒到桌面上,应先用抹布擦,再用大量水冲洗 |
查看答案和解析>>
科目:高中化学 来源: 题型:
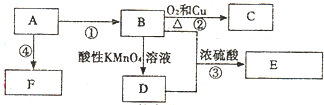
查看答案和解析>>
科目:高中化学 来源: 题型:
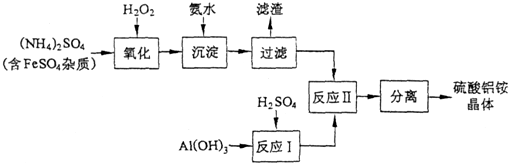
查看答案和解析>>
科目:高中化学 来源: 题型:
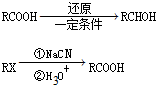
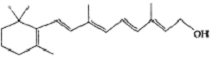 )和C.经元素分析及相对分子质量测定,确定C的分子式为C7H6O3,C遇FeCl3水溶液显紫色,与NaHCO3溶液反应有CO2产生.
)和C.经元素分析及相对分子质量测定,确定C的分子式为C7H6O3,C遇FeCl3水溶液显紫色,与NaHCO3溶液反应有CO2产生.| 还原 |
| HBr |
| ①NaCN |
| ②H2O |
| 浓H2SO4 |
| △ |
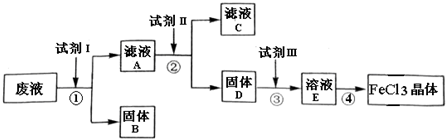
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、x+y<z |
| B、平衡向正反应方向移动 |
| C、B的转化率升高 |
| D、C的体积分数下降 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com