
(11分)有A、B、C、D、E五种短周期元素,它们的核电荷数按C、A、B、D、E的顺序依次增大。C、D都能分别与A按原子个数比为1∶1或2∶1形成化合物。CB可与EA2反应生成C2A和气态物质EB4。E的M层电子数是K层电子数的2倍。
(1)写出A、B、E元素的名称A:__________;B:_______________; E : ;
(2)写出电子式D2A2__________;
(3)写出D单质与CuSO4溶液反应的离子方程式_________________________
(4)C2A是由__________键形成的________分子 (填“极性”或“非极性”);中心原子杂化类型是 ,分子立体构型是 。
⑴A 氧 B 氟 E 硅 ⑵
⑶ 2Na + Cu2+ + 2H2O = 2Na+ + Cu(OH)2↓ + H2↑
⑷ 极性 极性 sp3 V形
【解析】E的M层电子数是K层电子数的2倍,则E是硅元素。所以EA2应是SiO2,即A是O。C、D都能分别与A按原子个数比为1∶1或2∶1形成化合物,所以C是H,D是Na。由EB4可知B属于第 ⅦA元素,根据原子序数的顺序可知B是F元素。D2A2是过氧化钠,含有离子键和非极性键,电子式为 。钠属于活泼性金属,极易与水反应,所以D单质与CuSO4溶液反应的离子方程式为2Na + Cu2+
+ 2H2O = 2Na+ + Cu(OH)2↓ + H2↑。在化合物H2O中,中心原子有2对孤对电子,其VSEPR模型是四面体,碳原子是sp3杂化,但实际构型是 V形 ,属于极性分子。
。钠属于活泼性金属,极易与水反应,所以D单质与CuSO4溶液反应的离子方程式为2Na + Cu2+
+ 2H2O = 2Na+ + Cu(OH)2↓ + H2↑。在化合物H2O中,中心原子有2对孤对电子,其VSEPR模型是四面体,碳原子是sp3杂化,但实际构型是 V形 ,属于极性分子。


 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案科目:高中化学 来源: 题型:阅读理解
| ||
| ||


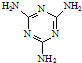 )俗称“蛋白精”.动物摄入三聚氰胺和三聚氰酸(
)俗称“蛋白精”.动物摄入三聚氰胺和三聚氰酸( 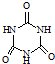 )后,三聚氰酸与三聚氰胺分子相互之间通过
)后,三聚氰酸与三聚氰胺分子相互之间通过| 化合物 | 密度/g?cm-3 | 沸点/℃ | 溶解度/100g水 |
| 正丁醇 | 0.810 | 118.0 | 9 |
| 冰醋酸 | 1.049 | 118.1 | ∞ |
| 乙酸正丁酯 | 0.882 | 126.1 | 0.7 |
查看答案和解析>>
科目:高中化学 来源:2011-2012学年辽宁省盘锦市二中高二下学期阶段考试化学试卷(带解析) 题型:填空题
(11分)有A、B、C三种烃的衍生物,相互转化关系如下:
其中B可发生银镜反应,C跟石灰石反应产生能使澄清石灰水变浑浊的气体.
(1)A、B、C的结构简式依次是___________, ___________, ____________.
(2)写出下列反应的化学方程式.
①A→B的化学方程式为:___________________________________________.
②B→C的化学方程式为:___________________________________________.
B发生银镜反应的化学方程式为;__________________________________.
③B→A的化学方程式为:___________________________________________.
查看答案和解析>>
科目:高中化学 来源:2014届福建省高一下学期期末考试化学试卷(解析版) 题型:填空题
(11分)物质结构和元素周期律是化学的重要理论知识,通过学习这部分知识,可以对所学元素化合物等知识从理论角度进一步加深理解。有A、B、C、D四种短周期元素,它们的原子序数由A到D依次增大,已知A和B原子有相同的电子层数,且A的L层电子数是K层电子数的两倍, C燃烧时呈现黄色火焰, C的单质在点燃条件下与B的单质充分反应,可以得到与D单质颜色相同的淡黄色固态化合物,试根据以上叙述完成下列问题:
(1)元素名称:A_________, B__________, C__________, D_________。
(2)写出B元素在周期表中的位置,第______周期,第________族。
(3)A与B可形成多种化合物,其中会引起温室效应的这一者的电子式为____________
(4)C单质在点燃条件下与B单质充分反应所得固体的化学为______________,该固体化合物类型为_______________,存在的作用力有________________。
(5) 用电子式表示化合物C2D的形成过程_____________________________________。
查看答案和解析>>
科目:高中化学 来源:2012届山西省高二下学期期中考试化学试卷 题型:填空题
(11分) (1)有A、B、C三种晶体,分别由C、H、Na、Cl四种元素中的一种或几种形成,对这三种晶体进行实验,结果见下表。
|
项目 |
熔点/℃[来源:Z。xx。k.Com] |
硬度 |
水溶性 |
导电性 |
水溶液与Ag+反应 |
|
A |
811 |
较大 |
易溶 |
水溶液(或熔融)导电 |
白色沉淀 |
|
B |
3 500 |
很大 |
不溶 |
不导电 |
不反应 |
|
C |
-114.2 |
很小 |
易溶 |
液态不导电 |
白色沉淀 |
① 晶体的化学式及晶体类型分别为:
A________ ____;B_______ ___;C____ ____。
② 晶体中粒子间的作用分别为:
A______ ___;B______ __;C_______ _。
(2)水是生命之源,它与我们的生活密切相关。在化学实验和科学研究中,水也是一种常用的试剂。
①写出与H2O分子互为等电子体的微粒__________(填一种即可)。
②水分子在特定条件下容易得到一个H+,形成水合氢离子(H3O+)。下列对上述过程的描述不合理的是( )
A.氧原子的杂化类型发生了改变 B.微粒的形状发生了改变
C.微粒的化学性质发生了改变 D.微粒中的键角发生了改变
③下列是钠、碘、金刚石、干冰、氯化钠晶体的晶胞图(未按顺序排序)。与冰的晶体类型相同的是______(请用相应的编号填写)

查看答案和解析>>
科目:高中化学 来源: 题型:
(11分)(1)有A、B、C三种晶体,分别由C、H、Na、Cl四种元素中的一种或几种形成,对这三种晶体进行实验,结果见下表。
| 项目 | 熔点/℃ | 硬度 | 水溶性 | 导电性 | 水溶液与Ag+反应 |
| A | 811 | 较大 | 易溶 | 水溶液(或熔融)导电 | 白色沉淀 |
| B | 3 500 | 很大 | 不溶 | 不导电 | 不反应 |
| C | -114.2 | 很小 | 易溶 | 液态不导电 | 白色沉淀 |
① 晶体的化学式及晶体类型分别为:
A________ ____;B_______ ___;C____ ____。
② 晶体中粒子间的作用分别为:
A______ ___;B______ __;C_______ _。
(2)水是生命之源,它与我们的生活密切相关。在化学实验和科学研究中,水也是一种常用的试剂。
①写出与H2O分子互为等电子体的微粒__________(填一种即可)。
②水分子在特定条件下容易得到一个H+,形成水合氢离子(H3O+)。下列对上述过程的描述不合理的是( )
A.氧原子的杂化类型发生了改变 B.微粒的形状发生了改变
C.微粒的化学性质发生了改变 D.微粒中的键角发生了改变
③下列是钠、碘、金刚石、干冰、氯化钠晶体的晶胞图(未按顺序排序)。与冰的晶体类型相同的是______(请用相应的编号填写)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com