
磷单质及其化合物在工业生产中有着广泛的应用。白磷可用于制备高纯度的磷酸(磷酸结构式为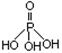 ),三聚磷酸钠(俗称“五钠”)是常用的水处理剂,次磷酸钠(NaH2PO2)可用于化学镀镍等等。
),三聚磷酸钠(俗称“五钠”)是常用的水处理剂,次磷酸钠(NaH2PO2)可用于化学镀镍等等。
完成下列填空:
(1)磷元素原子核外最外层电子排布式为 。NaH2PO2中涉及到四种元素,它们的原子半径由小到大的顺序为 。
(2)氧原子核外有 种不同能量的电子。
(3)写出与磷同周期的主族元素中,离子半径最小的元素,其最高价氧化物对应水化物的电离方程式 。
(4)磷酸二氢钠主要用于制革、处理锅炉水及在食品工业、发酵工业中作缓冲剂。其水溶液呈酸性的原因是_______________________________________________________。
(5)三聚磷酸可视为三个磷酸分子之间脱去两个水分子的产物,其结构式为 。三聚磷酸钠(俗称“五钠”)是常用的水处理剂,其化学式为____________。
(6)次磷酸钠(NaH2PO2)可用于化学镀镍。化学镀镍的溶液中含有Ni2+和H2PO2-,在一定条件下能发生如下反应:__Ni2++__H2PO2-+ →__Ni + ___H2PO3-+ 。请完成并配平上述反应离子方程式。该反应的还原产物是__________。
(1)3S23P3; H<O<P<Na
(2)3
(3)H+ + AlO2- + H2O  Al(OH)3
Al(OH)3 Al3+ + 3OH- (2分)
Al3+ + 3OH- (2分)
(4)磷酸二氢根离子电离程度大于水解程度 (2分)
(5)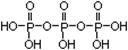 ; Na5P3O10
; Na5P3O10
(6)Ni2++H2PO2-+H2O→ Ni+H2PO3-+2H+ (2分) Ni
解析试题分析:(1)H原子有1个电子层,O有2个电子层,P和Na有3个电子层且Na质子数少半径大,故半径大小顺序为H<O<P<Na;
(2)氧原子电子排布式为1S22S22P4,同轨道电子能量相同,故3种不同能量的电子;
(3)H2PO2-为弱酸跟离子,在溶液中既能水解又能电离,水溶液呈酸性的原因说明其电离程度大于水解程度,以电离为主;
(4)磷酸分子间脱水应是两个羟基的脱水反应;三聚磷酸钠(俗称“五钠”)即是三聚磷酸中羟基氢被钠取代的产物;
(6)根据氧化还原反应电子守恒配平,氧化剂Ni2+生成还原产物Ni。
考点:考查化学基础中物质结构、氧化还原反应等有关问题。


 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案 小学学习好帮手系列答案
小学学习好帮手系列答案科目:高中化学 来源: 题型:填空题
水处理技术在生产、生活中应用广泛。
(1)工业上常用绿矾作混凝剂除去天然水中含有的悬浮物和胶体,为了达到更好的效果,要将待处理水的pH调到9左右,再加入绿矾。请解释这一做法的原因:_______________________________________________________________________。
(用必要的离子方程式和文字做答)
(2)根据水中Ca2+、Mg2+的多少,把天然水分为硬水和软水,硬水必须经过软化才能使用。①硬水软化的方法通常有________、________和离子交换法。离子交换树脂使用一段时间后,逐渐由NaR型变为CaR2(或MgR2)型,而失去交换能力。把CaR2(或MgR2)型树脂置于________中浸泡一段时间,便可再生。
②当洗涤用水硬度较大时,洗衣粉与肥皂相比,________洗涤效果较好,原因是________________________________________________________________________。
(3)我国某地苯胺大量泄漏于生活饮用水的河道中,当地采取的应急措施之一是向河水中撒入大量的活性炭,活性炭的作用是________________________________________。
(4)若生活污水中含大量的氮化合物,通常用生物膜脱氮工艺进行处理。首先在硝化细菌作用下将NH4+氧化为NO3-:________NH4++________O2=________NO3-+________H++______H2O,然后,加入甲醇与NO3-生成N2:______NO3-+______CH3OH=________N2↑+________CO2↑+________H2O+________OH-。
试配平以上两个离子方程式。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某体系中存在如下反应:
①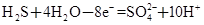 ②
②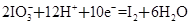
(1)反应①中H2S作_______剂,反应②属于_______反应。(填“氧化”或“还原”)
(2)若在反应①中失去0.2 mol电子,则反应②中可生成_______g碘。
(3)写出并配平碘酸钾与硫化氢反应的化学方程式,同时标出电子转移的方向和数目:______。
(4)由上述反应可推知_______。
a.氧化性:K2SO4>KIO3 b.酸性:HIO3>H2SO4
c.还原性:H2S>I2 d.反应过程中溶液的酸性逐渐减弱
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
氢化钠(NaH)是一种还原性极强的物质,广泛应用于工业生产。
(1)氢化钠(NaH)中氢元素的化合价为 。
(2)NaH能与水剧烈反应:NaH+H2O= NaOH+H2↑,该反应中的氧化剂是 。如果有12gNaH与水反应,则转移电子的个数为 。
(3)在高温下氢化钠(NaH)可将四氯化钛(TiC14)还原成金属钛,该反应的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
高铁酸盐在能源、环保等方面有着广泛的用途。湿法、干法制备高铁酸盐的原理如下表所示。
(1)工业上用湿法制备高铁酸钾(K2FeO4)的流程如下图所示:
|
 ①洗涤粗品时选用异丙醇而不用水的理由是: 。
①洗涤粗品时选用异丙醇而不用水的理由是: 。| 湿法 | 强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色高铁酸盐溶液 |
| 干法 | Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸盐和KNO2等产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
黄铜矿(CuFeS2)是制取铜及其化合物的主要原料之一,还可制备硫及铁的化合物。
(1)冶炼铜的反应为: 8CuFeS2+21O2 8Cu+4FeO+2Fe2O3+16SO2
8Cu+4FeO+2Fe2O3+16SO2
若CuFeS2中Fe的化合价为+2,反应中被还原的元素是 (填元素符号)。
(2)利用黄铜矿冶炼铜产生的炉渣(含Fe2O3、FeO、SiO2、Al2O3)可制备Fe2O3。方法为:
①用稀盐酸浸取炉渣,过滤。
②滤液先氧化,再加入过量NaOH溶液,过滤,将沉淀洗涤、干燥、煅烧得Fe2O3。
除去Al3+的离子方程式是 。
(3)为验证炉渣中含有FeO,先将炉渣用稀酸溶解,再在酸性条件下加入适当的氧化剂。(提供的试剂:稀盐酸、稀硫酸、KSCN溶液、酸性KMnO4溶液、NaOH溶液、碘水)
所选试剂为 、 ,证明炉渣中含有FeO的实验现象为 。
(4)配平上述反应的离子方程式(氧化性物质依据你的选择填入[ ])
Fe2++ H++ [ ] → Fe3++ [ ]+ H2O
(5)如果证明炉渣中是否含有FeO,将炉渣溶于稀硝酸,每含有1molFeO,可产生气体的体积是 L(标准状况,假设硝酸的还原产物只有NO)。
(6)Fe2O3可以作为染料,也可进一步制得净水剂Fe2(SO4)3, Fe2(SO4)3的净水原理是 (用相应的方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
合成氨和制备硝酸是两种重要的化工生产,重庆某化工厂将合成氨与制备硝酸进行连续生产。
(1)在某温度下体积为200 L的氨合成塔中,以分为单位的时间点上测得各物质的浓度(mol·L﹣1)如下表:
| | 0 min | l min | 2 min | 3 min | 4 min |
| N2 | 1.500 | 1.400 | 1.200 | c1 | c1 |
| H2 | 4.500 | 4.200 | 3.600 | c2 | c2 |
| NH3 | 0 | 0.200 | 0.600 | c3 | c3 |

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
金属冶炼和处理常涉及氧化还原反应。
(1)由下列物质冶炼相应金属时采用电解法的是 。
a.Fe2O3 b.NaCl c.Cu2S d.Al2O3
(2)辉铜矿(Cu2S)可发生反应2Cu2S+2H2SO4+5O2=4CuSO4+2 H2O,该反应的还原剂是 ,当1mol O2发生反应时,还原剂所失电子的物质的量为 mol。向CuSO4溶液中加入镁条时有气体生成,该气体是 。
(3)如图为电解精炼银的示意图, (填a或b)极为含有杂质的粗银,若b极有少量红棕色气体成,则生成该气体的电极反应式为 。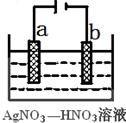
(4)为处理银器表面的黑斑(Ag2S),将银器置于铝制容器里的食盐水中并与铝接触,Ag2S转化为Ag,食盐水的作用为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,比Cl2、O2、ClO2、KMnO4氧化性更强,无二次污染,工业上是先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH至饱和,使高铁酸钾析出。
(1)干法制备高铁酸钾的主要反应为:
2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑
①该反应中的氧化剂是 ,还原剂是 。每生成1molNa2FeO4,转移 mol电子;
②简要说明K2FeO4作为水处理剂时所起的作用。
(2)湿法制备高铁酸钾(K2FeO4)的反应体系中有六种微粒:Fe(OH)3、ClO-、OH-、FeO42-、Cl-、H2O。
①写出并配平湿法制高铁酸钾反应的离子方程式 ;
②若反应过程中转移了0.3mol电子,则还原产物的物质的量为 。
(3)低温下,在高铁酸钠溶液中加入KOH至饱和可析出高铁酸钾(K2FeO4),试分析原因。 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com