
高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,比Cl2、O2、ClO2、KMnO4氧化性更强,无二次污染,工业上是先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH至饱和,使高铁酸钾析出。
(1)干法制备高铁酸钾的主要反应为:
2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑
①该反应中的氧化剂是 ,还原剂是 。每生成1molNa2FeO4,转移 mol电子;
②简要说明K2FeO4作为水处理剂时所起的作用。
(2)湿法制备高铁酸钾(K2FeO4)的反应体系中有六种微粒:Fe(OH)3、ClO-、OH-、FeO42-、Cl-、H2O。
①写出并配平湿法制高铁酸钾反应的离子方程式 ;
②若反应过程中转移了0.3mol电子,则还原产物的物质的量为 。
(3)低温下,在高铁酸钠溶液中加入KOH至饱和可析出高铁酸钾(K2FeO4),试分析原因。 。
(1)①Na2O2(1分)Na2O2和FeSO4(1分)5(2分)
②高铁酸钾具有强氧化性,能杀菌消毒;消毒过程中自身被还原为Fe3+,Fe3+水解生成Fe(OH)3胶体能吸附水中悬浮杂质而沉降(2分)
(2){1}2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O(2分)
{2}0.15mol(1分)
(3)该温度下K2FeO4的溶解度比Na2FeO4的溶解度小(1分)
解析试题分析:(1)干①元素化合价降低的物质是氧化剂:故为Na2O2,还原剂是Na2O2,FeSO4。根据化合价降低总数判断可知每生成1molNa2FeO4,转移5mol电子;②高铁酸钾具有强氧化性,能杀菌消毒;消毒过程中自身被还原为Fe3+,Fe3+水解生成Fe(OH)3胶体能吸附水中悬浮杂质而沉降,因此K2FeO4作为水处理剂。(2)湿法制备高铁酸钾(K2FeO4)的反应体系中有六种微粒:Fe(OH)3、ClO-、OH-、FeO42-、Cl-、H2O。①根据化合价有升必有降找出反应物和生成物,故湿法制高铁酸钾反应的离子方程式2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O;②根据该离子方程式,可判断出若反应过程中转移了0.3mol电子,则还原产物的物质的量为0.15mol。(3)低温下,在高铁酸钠溶液中加入KOH至饱和可析出高铁酸钾(K2FeO4),在溶液中发生了离子的交换使物质的溶解性发生了改变,可能的原因是该温度下K2FeO4的溶解度比Na2FeO4的溶解度小。
考点:考查新情景下氧化还原方程式的书写和配平,同时考查了氧化还原反应的概念和电子转移的计算。


科目:高中化学 来源: 题型:填空题
磷单质及其化合物在工业生产中有着广泛的应用。白磷可用于制备高纯度的磷酸(磷酸结构式为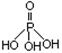 ),三聚磷酸钠(俗称“五钠”)是常用的水处理剂,次磷酸钠(NaH2PO2)可用于化学镀镍等等。
),三聚磷酸钠(俗称“五钠”)是常用的水处理剂,次磷酸钠(NaH2PO2)可用于化学镀镍等等。
完成下列填空:
(1)磷元素原子核外最外层电子排布式为 。NaH2PO2中涉及到四种元素,它们的原子半径由小到大的顺序为 。
(2)氧原子核外有 种不同能量的电子。
(3)写出与磷同周期的主族元素中,离子半径最小的元素,其最高价氧化物对应水化物的电离方程式 。
(4)磷酸二氢钠主要用于制革、处理锅炉水及在食品工业、发酵工业中作缓冲剂。其水溶液呈酸性的原因是_______________________________________________________。
(5)三聚磷酸可视为三个磷酸分子之间脱去两个水分子的产物,其结构式为 。三聚磷酸钠(俗称“五钠”)是常用的水处理剂,其化学式为____________。
(6)次磷酸钠(NaH2PO2)可用于化学镀镍。化学镀镍的溶液中含有Ni2+和H2PO2-,在一定条件下能发生如下反应:__Ni2++__H2PO2-+ →__Ni + ___H2PO3-+ 。请完成并配平上述反应离子方程式。该反应的还原产物是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
氢化亚铜(CuH)是一种难溶物质,用CuSO4溶液和“另一物质”在40 ℃~50 ℃时
反应可生成它。CuH不稳定,易分解;在氯气中能燃烧;与稀盐酸反应能生成气体;Cu+ 在酸
性条件下发生的反应是2Cu+ =Cu2++Cu。根据以上信息,结合自己所掌握的化学知识,回答:
(1)在CuSO4溶液和“另一物质”制CuH的反应中,用氧化还原观点分析,这“另一物质”在反应中所起的作用是________________。
(2)写出CuH在氯气中燃烧的化学反应方程式_______________________________。
(3)CuH溶解在稀盐酸中生成的气体是___________,如果反应中生成了标准状况下22.4 L的气体,被还原的离子得电子的物质的量是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)请把符合要求的化学方程式的字母填在下列空白处:
①既属于分解反应又是氧化还原反应的是____________________________
②属于分解反应,但不是氧化还原反应的是__________________________
③属于化合反应,但不是氧化还原反应的是__________________________
④不属于四种基本反应类型的氧化还原反应的是______________________
A.(NH4)2SO3  2NH3↑+H2O+SO2↑ 2NH3↑+H2O+SO2↑ |
| B.2KMnO4+16HCl(浓)= 2KCl+2MnCl2+ 5Cl2↑+ 8H2O |
C.2C+SiO2  Si+2CO↑ Si+2CO↑ |
D.NH4NO3  N2O↑+2H2O N2O↑+2H2O |
 MnCl2+Cl2↑+ 2H2O
MnCl2+Cl2↑+ 2H2O查看答案和解析>>
科目:高中化学 来源: 题型:填空题
在2KMnO4+16HCl=2MnCl2+2KCl+5Cl2↑+8H2O反应中。
(1) 元素被氧化,氧化产物是 ; 还原产物是 ;氧化剂和还原剂的物质的量之比为
(2)用双线桥法表示该反应的电子转移情况。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
在K2Cr2O7+14HCl=2KCl+2CrCl3+3Cl2↑+7H2O反应中, 是氧化剂, 是还原剂, 元素被氧化, 元素被还原,若0.3mol氯气生成则若0.3mol氯气生成转移的电子数目为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
已知盐酸参加的下列三个反应:
① CaCO3+2HCl=CaCl2+CO2↑+H2O
② Fe+2HCl=FeCl2+H2↑
③ MnO2+4HCl(浓)  MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
(1)判断上述三个反应中属于氧化还原反应的是_________,其中盐酸作还原剂的是__________。
(2)上述反应说明盐酸具有_______性,______性,_______性。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
已知硫氰(SCN)2为拟卤素,其分子及阴离子的性质与卤素性质相似。完成下列填空:将硫氰化钾溶液与氯化铁溶液混合,溶液变为血红色。
(1)写出该反应的化学方程式 。
将生成的血红色溶液分为四等份,进行如下实验(第四份是对照):
(2)第一份中加入少量的氯化钾固体,溶液的颜色 (填“会”或“不会”)加深。
(3)第二份中滴加入碘化钾溶液至过量,再加入四氯化碳,充分振荡,最终水层接近无色,四氯化碳层呈 色,写出该过程的离子方程式
。
向该溶液中滴加少量溴水,水溶液又变为血红色,则氧化性Br2 (SCN)2(填“大于”、“小于”或“无法确定”)。
(4)第三份中加入少量酸性高锰酸钾溶液,血红色褪去。完成并配平该反应的离子方程式。若含 mol高锰酸钾的溶液完全反应,转移电子2mol。
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
将12 .8g铜与一定浓度、一定体积的硝酸反应,铜完全溶解产生的NO和NO2混合气体在标准状况下的体积为4.48L,将反应后的溶液稀释至500mL,请计算:
(1)反应后溶液中硝酸铜的物质的量浓度?
(2)NO,NO2在标准状况下体积各为多少升?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com