
(1)请把符合要求的化学方程式的字母填在下列空白处:
①既属于分解反应又是氧化还原反应的是____________________________
②属于分解反应,但不是氧化还原反应的是__________________________
③属于化合反应,但不是氧化还原反应的是__________________________
④不属于四种基本反应类型的氧化还原反应的是______________________
A.(NH4)2SO3  2NH3↑+H2O+SO2↑ 2NH3↑+H2O+SO2↑ |
| B.2KMnO4+16HCl(浓)= 2KCl+2MnCl2+ 5Cl2↑+ 8H2O |
C.2C+SiO2  Si+2CO↑ Si+2CO↑ |
D.NH4NO3  N2O↑+2H2O N2O↑+2H2O |
 MnCl2+Cl2↑+ 2H2O
MnCl2+Cl2↑+ 2H2O(1) ① D ② A ③ E ④B、F
(2)1 14 2 2 3 7 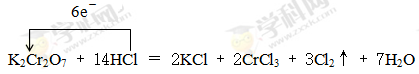 0.2
0.2
解析试题分析:(1)A、反应(NH4)2SO3  2NH3↑+H2O+SO2↑属于分解反应,元素的化合价均不变,因此不是氧化还原反应;B、反应2KMnO4+16HCl(浓)= 2KCl+2MnCl2+ 5Cl2↑+ 8H2O中Mn和Cl元素的化合价分别由+7价降低到+2价、-1价升高到0价,因此是氧化还原反应,但不属于四种基本反应类型;C、反应2C+SiO2
2NH3↑+H2O+SO2↑属于分解反应,元素的化合价均不变,因此不是氧化还原反应;B、反应2KMnO4+16HCl(浓)= 2KCl+2MnCl2+ 5Cl2↑+ 8H2O中Mn和Cl元素的化合价分别由+7价降低到+2价、-1价升高到0价,因此是氧化还原反应,但不属于四种基本反应类型;C、反应2C+SiO2  Si+2CO↑是置换反应,碳元素的化合价由0价升高到+2价,Si元素的化合价从+4价降低到0价,因此也是氧化还原反应;D、反应NH4NO3
Si+2CO↑是置换反应,碳元素的化合价由0价升高到+2价,Si元素的化合价从+4价降低到0价,因此也是氧化还原反应;D、反应NH4NO3  N2O↑+2H2O中NH4+中氮元素的化合价从-3价升高到+1价,NO3-中氮元素的化合价从+5价降低到+1价,因此是氧化还原反应,同时也是分解反应;E、反应Na2CO3+CO2+ H2O=2NaHCO3中元素的化合价均不变,不是氧化还原反应,属于化合反应;F、反应MnO2+4HCl(浓)
N2O↑+2H2O中NH4+中氮元素的化合价从-3价升高到+1价,NO3-中氮元素的化合价从+5价降低到+1价,因此是氧化还原反应,同时也是分解反应;E、反应Na2CO3+CO2+ H2O=2NaHCO3中元素的化合价均不变,不是氧化还原反应,属于化合反应;F、反应MnO2+4HCl(浓) MnCl2+Cl2↑+ 2H2O中Mn元素的化合价从+4价降低到+2价,氯元素的化合价从-1价升高到0价,因此是氧化还原反应,但不属于四种基本反应类型。则
MnCl2+Cl2↑+ 2H2O中Mn元素的化合价从+4价降低到+2价,氯元素的化合价从-1价升高到0价,因此是氧化还原反应,但不属于四种基本反应类型。则
①既属于分解反应又是氧化还原反应的是D;
②属于分解反应,但不是氧化还原反应的是A;
③属于化合反应,但不是氧化还原反应的是E;
④不属于四种基本反应类型的氧化还原反应的是B、F。
(2)根据方程式K2Cr2O7+HCl → KCl+CrCl3+Cl2↑+H2O可知,反应中Cr元素的化合价从+6价降低到+3价,得到3个电子。氯元素的化合价从-1价升高到0价,因此根据电子得失守恒可知,氧化剂K2Cr2O7 与还原剂HCl的物质的量之比是1:6。根据原子守恒可知氯化钾和CrCl3前面的化学计量数分别是2和2,则氯化氢的计量数是14,所以氢气的计量数是7,则配平后的化学方程式为K2Cr2O7+14HCl=2KCl+2CrCl3+3Cl2↑+7H2O,其中用单线桥可表示为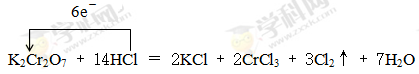 。
。
②若反应中,发生氧化反应的HCl为1.2 mol,则转移电子的物质的量是1.2mol。1molK2Cr2O7在反应中得到6mol电子,所以就电子得失守恒可知被还原的K2Cr2O7 物质的量为1.2mol÷6=0.2mol。
考点:考查氧化还原反应和四种基本反应类型的判断;氧化还原反应方程式配平和表示以及计算


 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案科目:高中化学 来源: 题型:填空题
氢化钠(NaH)是一种还原性极强的物质,广泛应用于工业生产。
(1)氢化钠(NaH)中氢元素的化合价为 。
(2)NaH能与水剧烈反应:NaH+H2O= NaOH+H2↑,该反应中的氧化剂是 。如果有12gNaH与水反应,则转移电子的个数为 。
(3)在高温下氢化钠(NaH)可将四氯化钛(TiC14)还原成金属钛,该反应的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
金属冶炼和处理常涉及氧化还原反应。
(1)由下列物质冶炼相应金属时采用电解法的是 。
a.Fe2O3 b.NaCl c.Cu2S d.Al2O3
(2)辉铜矿(Cu2S)可发生反应2Cu2S+2H2SO4+5O2=4CuSO4+2 H2O,该反应的还原剂是 ,当1mol O2发生反应时,还原剂所失电子的物质的量为 mol。向CuSO4溶液中加入镁条时有气体生成,该气体是 。
(3)如图为电解精炼银的示意图, (填a或b)极为含有杂质的粗银,若b极有少量红棕色气体成,则生成该气体的电极反应式为 。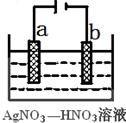
(4)为处理银器表面的黑斑(Ag2S),将银器置于铝制容器里的食盐水中并与铝接触,Ag2S转化为Ag,食盐水的作用为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
水(H2O)在很多化学反应中有极其重要的作用。请研究下列水参与的氧化还原反应。
①NaH+H2O=NaOH+H2↑ ②2Na2O2+2H2O=4NaOH+O2↑
③2Na+2H2O="2NaOH" +H2↑ ④3NO2+H2O=2HNO3+NO↑
⑤2H2O 2H2↑+O2↑ ⑥2F2+2H2O=4HF+O2
2H2↑+O2↑ ⑥2F2+2H2O=4HF+O2
(1)水只作氧化剂的是 ;水只作还原剂的是 ;水既作氧化剂,又作还原剂的是 ;水既不作氧化剂,又不是还原剂的是 。
(2)水作氧化剂时,被还原的元素是 ,水作还原剂时,被氧化的元素是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
我国目前使用碘酸钾作为食用盐中碘强化剂。并规定,食用盐碘含量的平均水平(以碘元素计)为20 mg/kg ~ 30 mg/kg。
(1)碘酸钾与碘化钾在酸性条件下发生如下反应,请配平化学方程式。
KIO3+ KI+ H2SO4= K2SO4+ I2+ H2O
反应中有1.5mol I2生成时转移电子数是 。
(2)已知:I2+2S2O32-=2 I-+S4O62-,某学生测定食用精制盐的碘含量,其步骤为:
a.准确称取20 .0g食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
c.以淀粉为指示剂,逐滴加入物质的量浓度为2.0×10-3 mol/L的Na2S2O3溶液10.0 mL,恰好反应完全。
①判断c中反应恰好完全依据的现象是 。
②根据以上实验和包装袋说明,所测精制盐的碘含量是 mg/kg。(保留一位小数)
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
实验室中所用少量氯气是用下列方法制取的:
4HCl(浓)+MnO2 Cl2↑+MnCl2+2H2O
Cl2↑+MnCl2+2H2O
(1)该反应既是离子反应也是氧化还原反应。该反应的还原剂是 (用化学式表示)。
氯气有毒会污染空气,实验室常用氢氧化钠吸收该实验的尾气,写出用氢氧化钠溶液吸收氯气的离子方程式 。
(2)若有17.4gMnO2与足量的浓盐酸充分反应后, 所得溶液的体积为500 mL,求:
①转移电子数为______ _;
②被氧化的HCl的物质的量_______ mol;
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,比Cl2、O2、ClO2、KMnO4氧化性更强,无二次污染,工业上是先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH至饱和,使高铁酸钾析出。
(1)干法制备高铁酸钾的主要反应为:
2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑
①该反应中的氧化剂是 ,还原剂是 。每生成1molNa2FeO4,转移 mol电子;
②简要说明K2FeO4作为水处理剂时所起的作用。
(2)湿法制备高铁酸钾(K2FeO4)的反应体系中有六种微粒:Fe(OH)3、ClO-、OH-、FeO42-、Cl-、H2O。
①写出并配平湿法制高铁酸钾反应的离子方程式 ;
②若反应过程中转移了0.3mol电子,则还原产物的物质的量为 。
(3)低温下,在高铁酸钠溶液中加入KOH至饱和可析出高铁酸钾(K2FeO4),试分析原因。 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
请将5种物质:N2O、FeCl2、Fe (NO3)3、HNO3和FeCl3分别填入下面对应的横线上,组成一个未配平的化学方程式。
(1)_________+__________→__________+__________+__________+H2O(不需配平)
(2)反应过程中,N2O与FeCl2的物质的量之比为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
已知氮元素有许多化合价,其化合价有-3、0、+1、+2、+3、+4、+5
(1)下表是硝酸与某种金属M在某些条件下反应所得还原产物的关系: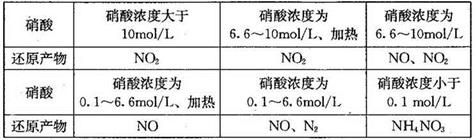
通过分析上表可得出的结论是:当硝酸与金属M反应时,________________。
金属锌与某浓度的硝酸反应时,无气体产生,则此化学反应中被还原的硝酸与参加反应的硝酸物质的量之比是________。
(2)以氨作为燃料的固体氧化物(含有O2-)燃料电池,具有全固态结构、能量效率高、无污染等特点,另外氨气含氢量高,不含碳,易液化,方便运输和贮存,是很好的氢源载体。其工作原理如图所示: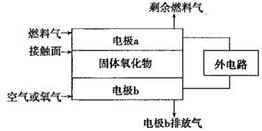
①该电池工作时的总反应为______ __
②固体氧化物作为电池工作的电解质,O2-移动方向为________(选填“由电极a向电极b”或“由电极b向电极a”)。
③该电池工作时,在接触面上发生的电极反应为________。
(3)N2O5是一种新型硝化剂,其性质和制备 受到人们的关注。如图所示装置可用于制备N2O5,写出在电解池中生成N2O5的电极反应式________________。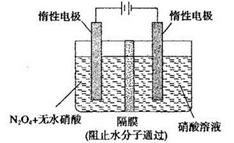
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com