
已知氮元素有许多化合价,其化合价有-3、0、+1、+2、+3、+4、+5
(1)下表是硝酸与某种金属M在某些条件下反应所得还原产物的关系: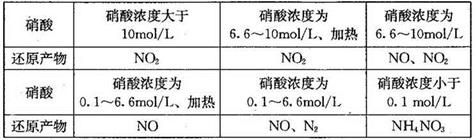
通过分析上表可得出的结论是:当硝酸与金属M反应时,________________。
金属锌与某浓度的硝酸反应时,无气体产生,则此化学反应中被还原的硝酸与参加反应的硝酸物质的量之比是________。
(2)以氨作为燃料的固体氧化物(含有O2-)燃料电池,具有全固态结构、能量效率高、无污染等特点,另外氨气含氢量高,不含碳,易液化,方便运输和贮存,是很好的氢源载体。其工作原理如图所示: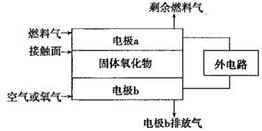
①该电池工作时的总反应为______ __
②固体氧化物作为电池工作的电解质,O2-移动方向为________(选填“由电极a向电极b”或“由电极b向电极a”)。
③该电池工作时,在接触面上发生的电极反应为________。
(3)N2O5是一种新型硝化剂,其性质和制备 受到人们的关注。如图所示装置可用于制备N2O5,写出在电解池中生成N2O5的电极反应式________________。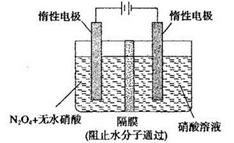
(1)硝酸的浓度或温度不同,硝酸的还原产物也不同; 1:10
(2)4NH3+3O2=2N2+6H2O;由电极b向电极a;2NH3+3O2—-6e-=N2+3H2O
(3)N2O4+2HNO3-2e-=2N2O5+2H+
解析试题分析:(1)分析表格,可知硝酸的浓度及反应温度不同,硝酸的还原产物也不同。
Zn与硝酸反应无气体产生,说明硝酸的还原产物为NH4NO3,据此可此而出方程式:4Zn+10HNO3=4Zn(NO3)3+NH4NO3+3H2O,生成NH4NO3中NH4+的硝酸是被还原的硝酸,其与参与反应的硝酸的物质的量之比为1:10。
(2)电池总反应是NH3和O2反应,生成N2和H2O。
在原电池电解质中,阴离子移向负极,阳离子移向正极,燃料电池通入燃料的a极为负极,通入空气的b极为正极,因此O2-由b移向a。
接触面上发生的反应是负极的燃料NH3失电子,与电解质O2-结合生成N2和H2O。
(3)电解时,阳极失电子,因此N2O4和HNO3失电子产生N2O5。
考点:考查氧化还原反应,燃料电池,电解池,电极反应式书写。


 全优点练单元计划系列答案
全优点练单元计划系列答案科目:高中化学 来源: 题型:填空题
(1)请把符合要求的化学方程式的字母填在下列空白处:
①既属于分解反应又是氧化还原反应的是____________________________
②属于分解反应,但不是氧化还原反应的是__________________________
③属于化合反应,但不是氧化还原反应的是__________________________
④不属于四种基本反应类型的氧化还原反应的是______________________
A.(NH4)2SO3  2NH3↑+H2O+SO2↑ 2NH3↑+H2O+SO2↑ |
| B.2KMnO4+16HCl(浓)= 2KCl+2MnCl2+ 5Cl2↑+ 8H2O |
C.2C+SiO2  Si+2CO↑ Si+2CO↑ |
D.NH4NO3  N2O↑+2H2O N2O↑+2H2O |
 MnCl2+Cl2↑+ 2H2O
MnCl2+Cl2↑+ 2H2O查看答案和解析>>
科目:高中化学 来源: 题型:填空题
已知硫氰(SCN)2为拟卤素,其分子及阴离子的性质与卤素性质相似。完成下列填空:将硫氰化钾溶液与氯化铁溶液混合,溶液变为血红色。
(1)写出该反应的化学方程式 。
将生成的血红色溶液分为四等份,进行如下实验(第四份是对照):
(2)第一份中加入少量的氯化钾固体,溶液的颜色 (填“会”或“不会”)加深。
(3)第二份中滴加入碘化钾溶液至过量,再加入四氯化碳,充分振荡,最终水层接近无色,四氯化碳层呈 色,写出该过程的离子方程式
。
向该溶液中滴加少量溴水,水溶液又变为血红色,则氧化性Br2 (SCN)2(填“大于”、“小于”或“无法确定”)。
(4)第三份中加入少量酸性高锰酸钾溶液,血红色褪去。完成并配平该反应的离子方程式。若含 mol高锰酸钾的溶液完全反应,转移电子2mol。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
氮及其化合物与我们的吃、穿、住、行、健康等都有着密切的联系,也是高中化学学习中重要的一部分。请回答下列问题:
I.(1)现有一支15mL的试管,充满NO倒置于水槽中,向试管中缓缓通入一定量氧气,当试管内液面稳定时,剩余气体3mL。则通入氧气的体积可能为 。 (2)一定条件下,某密闭容器中发生反应:4NH3(g)+5O2(g) 4NO(g)+6H2O(g)。
(2)一定条件下,某密闭容器中发生反应:4NH3(g)+5O2(g) 4NO(g)+6H2O(g)。
| 起始浓度( mol/L) | C(NH3) | C(O2) | C(NO) | C(H2O) |
| 甲 | 1 | 2 | 0 | 0 |
| 乙 | 4 | 8 | 0 | 0 |
| 丙 | 0.2 | x | y | z |
 N2O4(g)△H<0。恒温恒容下反应相同时间后,分别测定体系中NO2的百分含量分别为a1和a2;已知T1< T2,则a1_ a2。
N2O4(g)△H<0。恒温恒容下反应相同时间后,分别测定体系中NO2的百分含量分别为a1和a2;已知T1< T2,则a1_ a2。查看答案和解析>>
科目:高中化学 来源: 题型:填空题
为了防止枪支生锈,常将枪支的钢铁零件放在NaNO2和NaOH的混合液中进行化学处理使钢铁零件表面生成Fe3O4的致密的保护层——“发蓝”。其过程可用下列化学方程式表示:
①3Fe NaNO2
NaNO2 5NaOH → 3Na2FeO2
5NaOH → 3Na2FeO2 H2O
H2O NH3↑
NH3↑
② Na2FeO2 NaNO2
NaNO2 H2O → Na2Fe2O4
H2O → Na2Fe2O4 NH3↑
NH3↑ NaOH
NaOH
③Na2FeO2 Na2Fe2O4
Na2Fe2O4 2H2O
2H2O Fe3O4
Fe3O4 4NaOH
4NaOH
(1)配平化学方程式②。
(2)上述反应①中还原剂为 ,被还原的是 。若有1mol Na2FeO2生成,则反应中有 mol电子转移。
(3)关于形成“发蓝”的过程,下列说法正确的是…………………………………………( )
| A.该生产过程不会产生污染 | B.反应③生成的四氧化三铁具有抗腐蚀作用 |
| C.反应①②③均是氧化还原反应 | D.反应①②中的氧化剂均为NaNO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
(10分)(1)向用氯化铁溶液刻制印刷电路后的废液中,加入足量铁粉,发生反应的离子方程式是 、 。
(2)实验室向某溶液中加入硫氰化钾溶液,无现象,滴加少量氯水,立即变为红色,则原溶液中含有(填离子符号) ,写出滴加氯水时发生反应的离子方程式 。
(3)我们知道,浓硫酸有脱水性、吸水性和氧化性,请写出证明浓硫酸具有氧化性的反应的化学方程式(写一个,多写若有一个错误,本题不得分) 。
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
将12 .8g铜与一定浓度、一定体积的硝酸反应,铜完全溶解产生的NO和NO2混合气体在标准状况下的体积为4.48L,将反应后的溶液稀释至500mL,请计算:
(1)反应后溶液中硝酸铜的物质的量浓度?
(2)NO,NO2在标准状况下体积各为多少升?
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(7分)海水是巨大的资源宝库,从海水中提取食盐和溴的过程如下:
(1)步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br-,其目的是_____________________。
(2)步骤Ⅱ用SO2水溶液吸收Br2,吸收率可达95%,有关反应的离子方程式为_________________,
由此反应可知,除环境保护外,在工业生产中应解决的主要问题是: _________________。
(3)兰州一中某化学研究性学习小组为了了解从工业溴中提纯溴的方法,查阅了有关资料知:Br2的沸点为59 ℃,微溶于水,有毒并有强腐蚀性。他们参观生产过程后,画了如下装置简图:
请你参与分析讨论:
①图中仪器B的名称是__________。
②实验装置气密性良好,要达到提纯溴的目的,操作中如何控制关键条件? ____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
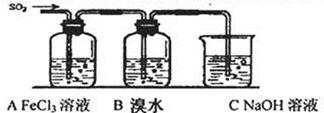
硫及其化合物有广泛的应用,对SO2性质的研究是高中化学教学的一项重要内容。
I.对比研究是一种重要的研究方法。若将硫的单质及部分化合物按如下表所示分成3 组,则第2组中物质M的化学式是 。
| 第1组 | 第2组 | 第3组 |
| S (单质) | SO2、H2SO3、M、NaHSO3 | SO3、H2SO4、Na2SO4、 NaHSO4 |
| n(SO32—):n(HSO3—) | 91:9 | 1:1 | 9:91 |
| pH | 8.2 | 7.2 | 6.2 |
| 序号 | 实验方案 | 实验现象 | 结论 |
| 方案① | 往第一份试液中加入KMnO4溶液溶液 | 紫红色褪去 | SO2与Fe3+反应生成了Fe2+ |
| 方案② | 往第二份试液中加入 | | SO2与Fe3+反应生成了Fe2+ |
| 方案③ | 往第二份试液中加入 | | SO2与Fe3+反应生成了SO42— |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com