
硫及其化合物有广泛的应用,对SO2性质的研究是高中化学教学的一项重要内容。
I.对比研究是一种重要的研究方法。若将硫的单质及部分化合物按如下表所示分成3 组,则第2组中物质M的化学式是 。
| 第1组 | 第2组 | 第3组 |
| S (单质) | SO2、H2SO3、M、NaHSO3 | SO3、H2SO4、Na2SO4、 NaHSO4 |
| n(SO32—):n(HSO3—) | 91:9 | 1:1 | 9:91 |
| pH | 8.2 | 7.2 | 6.2 |
| 序号 | 实验方案 | 实验现象 | 结论 |
| 方案① | 往第一份试液中加入KMnO4溶液溶液 | 紫红色褪去 | SO2与Fe3+反应生成了Fe2+ |
| 方案② | 往第二份试液中加入 | | SO2与Fe3+反应生成了Fe2+ |
| 方案③ | 往第二份试液中加入 | | SO2与Fe3+反应生成了SO42— |
(15分)
Ⅰ.Na2SO3(2分)
Ⅱ. (1)BD(2分) (2) AC (2分)
(3)否 (1分) SO2、Fe2+都能使酸性高锰酸钾溶液褪色(2分)
方案②:往第二份试液加入KSCN溶液,观察现象,再加入新制的氯水,(1分)先不变红,后溶液变红。(1分)
方案③:往第三份试液加入稀盐酸酸化,再加入BaCl2溶液(1分) 产生白色沉淀。(1分)
(4)B 中橙色(或黄色)褪去(2分)
解析试题分析:
Ⅰ.第2组中硫元素都为+4价。
Ⅱ.(1)A、HNO3有挥发性,错误; B、可行;C、该方法不适合实验室使用,错误;D、可行
(2)A、符合电荷守恒,正确;B、C比较,当比值为10:1是,溶液呈碱性,说明SO32-浓度比 HSO3-大。
(3)SO2如果和Fe3+发生氧化还原产物为SO42-和Fe2+,因此需要检验这两个离子。
方案①不合理,SO2也能让高锰酸钾褪色。
(4)B 中橙色(或黄色)褪去,说明还原性小于SO2
考点:本题考查了实验的基本操作,溶液中三个守恒关系,实验方案设计等知识点,要求学生对实验的原理清楚。


科目:高中化学 来源: 题型:填空题
已知氮元素有许多化合价,其化合价有-3、0、+1、+2、+3、+4、+5
(1)下表是硝酸与某种金属M在某些条件下反应所得还原产物的关系: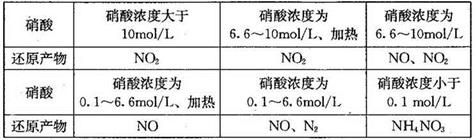
通过分析上表可得出的结论是:当硝酸与金属M反应时,________________。
金属锌与某浓度的硝酸反应时,无气体产生,则此化学反应中被还原的硝酸与参加反应的硝酸物质的量之比是________。
(2)以氨作为燃料的固体氧化物(含有O2-)燃料电池,具有全固态结构、能量效率高、无污染等特点,另外氨气含氢量高,不含碳,易液化,方便运输和贮存,是很好的氢源载体。其工作原理如图所示: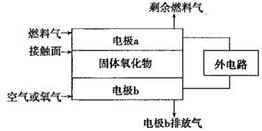
①该电池工作时的总反应为______ __
②固体氧化物作为电池工作的电解质,O2-移动方向为________(选填“由电极a向电极b”或“由电极b向电极a”)。
③该电池工作时,在接触面上发生的电极反应为________。
(3)N2O5是一种新型硝化剂,其性质和制备 受到人们的关注。如图所示装置可用于制备N2O5,写出在电解池中生成N2O5的电极反应式________________。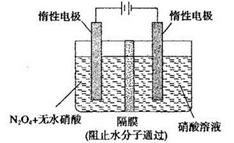
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某研究小组对“Br2和I2能否将Fe2+氧化为Fe3+”这一课题进行实验和探究。请你完成相关问题的回答。
(1)提出合理的假设
假设1: Br2和I2都可以将Fe2+氧化为Fe3+;
假设2: Br2和I2都不能将Fe2+氧化为Fe3+;
假设3:
(2)实验验证
在大试管中加适量铁粉,加入10 mL 稀硫酸,振荡试管,充分反应后,铁粉有剩余,将所得的FeSO4溶液稀释到200mL,备用。
实验Ⅰ:向试管1中加入2 mL浅绿色的 FeSO4溶液,再滴加少量红棕色的溴水,振荡试管,溶液为黄色;
实验Ⅱ:向试管2中加入2 mL浅绿色的 FeSO4溶液,再滴加少量棕黄色的碘水,振荡试管,溶液为黄色。
(3)对实验现象的分析与讨论
①甲同学认为实验Ⅰ的现象说明溴水能将Fe2+氧化,离子方程式为 。
②乙同学认为应该补充实验,才能得出甲的结论。乙的实验操作以及预期现象是 。
③该小组同学对实验Ⅱ中溶液呈黄色的原因展开了讨论:
可能1:碘水与 FeSO4溶液不反应,黄色是碘水稀释后的颜色。
可能2: 。
丙同学和丁同学分别设计了以下实验方案以确定可能的原因。
丙方案:向试管2所得溶液中继续加入0.5mLCCl4,充分振荡,静置一段时间后。取出上层溶液,滴加几滴KSCN 溶液;
丁方案:向试管2所得溶液中继续加入加入0.5mL乙酸乙酯,充分振荡,静置一段时间后。取出下层溶液,滴加几滴KSCN 溶液;
你认为 方案为最佳方案,理由是 。
(4)拓展延伸
①为准确测定此实验所用的FeSO4溶液的浓度,某同学补充了以下实验:
滴定:量取20.00mL稀释后得到的溶液于锥形瓶中,将0.0200mol/LKMnO4标准溶液装入50mL中,滴定至终点,记录数据。重复滴定2次。平均消耗KMnO4溶液V mL。
②计算:此实验中所用的FeSO4溶液的物质的量浓度= mol/L(要求只列出算式,不需运算)。
(已知反应式:Fe2+ + MnO4- +H+ — Fe3+ + Mn2+ + H2O,未配平)
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
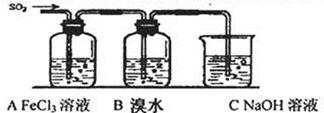
某兴趣小组探究SO2气体还原Fe3+、I2,他们使用的药品和装置如下图所示: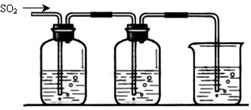
FeCl3溶液 含有淀粉的碘水 NaOH溶液
A B C
(1)在配制氯化铁溶液时,需先把氯化铁晶体溶解在 中,再加水稀释,这样操作的目的是 。
(2)装置C的作用是 。
(3)若要从A中所得溶液提取晶体,必须进行的实验操作步骤:蒸发、冷却结晶、 、自然干燥,在这一系列操作中没有用到的仪器有 (填序号)。
| A.蒸发皿 |
| B.石棉网 |
| C.漏斗 |
| D.烧杯 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某兴趣小组挤究SO2气体还原Fe3+、I2,他们使用的药品和装置如下图所示: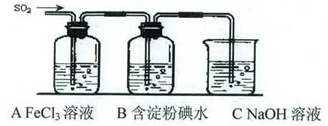
(1)SO2气体还原Fe3+反应的产物是_____________、_____________(填离子符号)。
(2)下列实验方案可以用于在实验室制取所需SO2的是____。
| A.Na2SO3溶液与HNO3 | B.Na2SO3固体与浓硫酸 |
| C.固体硫在纯氧中燃烧 | D.铜与热浓H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列关于Na2O2的叙述,正确的是 ( )
| A.Na2O2晶体中的阴离子与阳离子的物质的量之比为1:1 |
| B.Na2O2晶体为离子晶体,且含极性共价键 |
| C.Na2O2应保存于密封、干燥带玻璃塞的广口瓶中 |
| D.Na2O2与盐酸反应,不仅有盐和水生成,同时会放出无色气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
部分氧化的铁铜合金样品(氧化产物为Fe2O3、CuO)共5.76 g,经如下处理: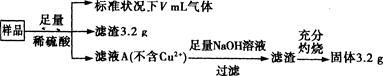
下列说法正确的是 ( )
| A.滤液A中的阳离子为Fe3+、Fe2+、H+ |
| B.V=896 |
| C.样品中CuO的质量为4.0 g |
| D.样品中Fe元素的质量为2.24g |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
将一定量的铁片和浓硫酸混合加热,充分应后得到溶液X,X中除Fe3+外还可能含有Fe2+。若要确认其中的Fe2+,应选用( )
| A.KSCN溶液和氯水 | B.铁粉和KSCN溶液 |
| C.浓氨水 | D.酸性KMnO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
所谓合金,就是不同种金属(也包括一些非金属)在熔化状态下形成的一种熔合物,下表为四种金属的熔、沸点:
| | Na | Cu | Al | Fe |
| 熔点(℃) | 97.5 | 1 083 | 660 | 1 535 |
| 沸点(℃) | 883 | 2 595 | 2 200 | 3 000 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com