
某兴趣小组挤究SO2气体还原Fe3+、I2,他们使用的药品和装置如下图所示: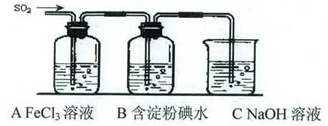
(1)SO2气体还原Fe3+反应的产物是_____________、_____________(填离子符号)。
(2)下列实验方案可以用于在实验室制取所需SO2的是____。
| A.Na2SO3溶液与HNO3 | B.Na2SO3固体与浓硫酸 |
| C.固体硫在纯氧中燃烧 | D.铜与热浓H2SO4 |
(本题共12分)(1)Fe2+、SO42-;(2分) (2)BD(2分)
(3)除去多余的SO2,防止污染空气(2分)。 (4)0.25mol/L(2分)
(5)①;SO2、Fe2+都能使酸性高锰酸钾褪色(2分)
(6)B中蓝色褪去;I2+SO2+2H2O→4H++2I- +SO42-(2分)
解析试题分析:(1)铁离子具有氧化性,SO2具有还原性,二者发生氧化还原反应,反应的方程式是2Fe3++SO2+2H2O=2Fe2++SO42-+4H+,所以SO2气体还原Fe3+反应的产物是Fe2+、SO42-。
(2)A、硝酸具有强氧化性,把亚硫酸钠氧化成硫酸钠,得不到二氧化硫,故A错;B、浓硫酸虽具有强氧化性性,但不能氧化亚硫酸钠,故B正确;C、固体硫在纯氧中燃烧,操作以及氧气的用量不容易控制,故C错;D、Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O,故D正确答案选BD。
CuSO4+SO2↑+2H2O,故D正确答案选BD。
(3)SO2是大气污染物,直接排放容易造成环境污染,所以需要尾气处理。由于二氧化硫是酸性氧化物能和碱反应生成盐和水,所以可用碱液处理二氧化硫,所以重装C的作用是除去多余的SO2,防止污染空气。
(4)SO2的物质的量是0.28L÷22.4L/mol=0.0125mol,和氢氧化钠溶液反应生成亚硫酸氢钠时消耗的氢氧化钠最少,所以至少需要氢氧化钠的物质的量是0.0125mol,其浓度是0.0125mol÷0.05L=0.25mol/L。
(5)因为SO2、Fe2+均具有还原性,二者都能使酸性高锰酸钾褪色,所以方案①是错误的。
(6)二氧化硫能使含有碘的淀粉溶液褪色,说明发生了氧化还原反应,有关反应的方程式是I2+SO2+2H2O→4H++2I- +SO42-。在反应中碘是氧化剂,二氧化硫是还原剂,还原剂的还原性大于还原产物的还原性,所以能表明I-的还原性弱于SO2的现象是B中蓝色溶液褪色。
考点:考查SO2的制备、性质检验;氧化还原反应的有关判断以及实验方案设计和评价等


科目:高中化学 来源: 题型:填空题
为了防止枪支生锈,常将枪支的钢铁零件放在NaNO2和NaOH的混合液中进行化学处理使钢铁零件表面生成Fe3O4的致密的保护层——“发蓝”。其过程可用下列化学方程式表示:
①3Fe NaNO2
NaNO2 5NaOH → 3Na2FeO2
5NaOH → 3Na2FeO2 H2O
H2O NH3↑
NH3↑
② Na2FeO2 NaNO2
NaNO2 H2O → Na2Fe2O4
H2O → Na2Fe2O4 NH3↑
NH3↑ NaOH
NaOH
③Na2FeO2 Na2Fe2O4
Na2Fe2O4 2H2O
2H2O Fe3O4
Fe3O4 4NaOH
4NaOH
(1)配平化学方程式②。
(2)上述反应①中还原剂为 ,被还原的是 。若有1mol Na2FeO2生成,则反应中有 mol电子转移。
(3)关于形成“发蓝”的过程,下列说法正确的是…………………………………………( )
| A.该生产过程不会产生污染 | B.反应③生成的四氧化三铁具有抗腐蚀作用 |
| C.反应①②③均是氧化还原反应 | D.反应①②中的氧化剂均为NaNO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某化学兴趣小组在探究卤素单质的氧化性的实验中发现,在足量的氯化亚铁溶液中,加入1~2滴溴水,振荡后溶液呈黄色,原因是什么?Br2能否氧化Fe2+,Fe3+与Br2谁的氧化性更强?
(1)甲同学认为:Br2不能氧化Fe2+,Fe3+的氧化性大于Br2,产生上述现象的原因不是化学反应所致,溶液呈黄色是含 (填化学式,下同)所致。
(2)乙同学认为:Br2将Fe2+氧化为Fe3+,Fe3+的氧化性小于Br2,产生上述现象的原因是化学反应所致,则溶液呈黄色是含 所致。
(3)丙同学为验证乙同学的观点,选择下列试剂,设计出两种方案进行实验,并通过观察实验现象,证明了乙同学的观点是正确的,供选用的试剂:a.酚酞试剂;b.CCl4;c.无水酒精;d.KSCN溶液。请你在下表中写出丙同学选用的试剂及实验中观察到的现象。(试剂填序号)
| 选用试剂 | 实验现象 |
| 方案1 | |
| 方案2 | |
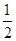 的Br-被氧化成单质Br2,则原FeBr2溶液的物质的量浓度是 。
的Br-被氧化成单质Br2,则原FeBr2溶液的物质的量浓度是 。查看答案和解析>>
科目:高中化学 来源: 题型:实验题
硫酸钠-过氧化氢-氯化钠加合物(xNaSO4·yH2O2·zNaCl)又称固体双氧水,是一种新型精细化工产品,具有漂白、杀菌、消毒等作用。为探究该加合物的组成,某化学兴趣小组设计并进行了如下实验:
第一步:准确称取6.945g样品,配制成250.00ml无色溶液A
第二步:准确量取25.00ml溶液A于锥形瓶中,加适量稀硫酸酸化后,用0.0400mol/LKMnO4标准溶液滴定至终点,消耗溶液KMnO420.00ml
第三步:另取25.00ml溶液A,加入盐酸酸化的BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体0.932g.
请回答下列问题:
(1)欲配制无色溶液A,所需要的仪器除药匙、分析天平、玻璃棒、胶头滴管外,还应有 。
(2)配平下列离子方程式______MnO4-+_____H2O2+_________=______Mn2++_____O2↑+______。
(3)滴定前,KMnO4标准溶液应盛装于中 (填仪器名称),滴定终点现象为 。
(4)第三步能否通过加入AgNO3溶液的方法来测定?为什么
(5)滴定前,滴定管用蒸馏水洗净后,未用KMnO4标准溶液润洗,则Y值______________(填“偏
高 偏低 无影响”)
(6)通过计算确定样品的组成为 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
Na2SO3在空气中易被氧化而变质。某同学为证明Na2SO3有还原性,从一瓶实验室长期存放的Na2SO3固体中取出少量溶于水,滴入一定量的烧碱溶液和少许溴水,振荡后溶液变为无色。
(1)在碱性溶液中Br2和Na2SO3反应的离子方程式 。
(2)反应后的溶液含有SO32-、SO42-、Br-、OH-等阴离子,下表是某同学鉴定其中SO32-、SO42-和Br-的实验报告,请完成未填完的部分。
限选试剂:2 mol·L-1HCl;1 mol·L-1 H2SO4;l mol·L-1BaCl2;l mol·L-1Ba(NO3)2;1 mol·L-1 KMnO4、CCl4;新制饱和氯水;品红溶液。
| 编号 | 实验操作 | 预期现象和结论 |
| 步骤① | 取少量待测液加入试管中,加入过量2mol·L-1HCl,再滴加适量1 mol·L-1BaCl2 溶液。 | 有白色沉淀生成,证明待测液中含有、SO42- 。 |
| 步骤② | | |
| 步骤③ | | |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
硫及其化合物有广泛的应用,对SO2性质的研究是高中化学教学的一项重要内容。
I.对比研究是一种重要的研究方法。若将硫的单质及部分化合物按如下表所示分成3 组,则第2组中物质M的化学式是 。
| 第1组 | 第2组 | 第3组 |
| S (单质) | SO2、H2SO3、M、NaHSO3 | SO3、H2SO4、Na2SO4、 NaHSO4 |
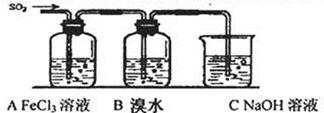
| n(SO32—):n(HSO3—) | 91:9 | 1:1 | 9:91 |
| pH | 8.2 | 7.2 | 6.2 |
| 序号 | 实验方案 | 实验现象 | 结论 |
| 方案① | 往第一份试液中加入KMnO4溶液溶液 | 紫红色褪去 | SO2与Fe3+反应生成了Fe2+ |
| 方案② | 往第二份试液中加入 | | SO2与Fe3+反应生成了Fe2+ |
| 方案③ | 往第二份试液中加入 | | SO2与Fe3+反应生成了SO42— |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
观察是研究物质性质的一种基本方法.一同学将一小块金属钠露置于空气中,观察到下列现象:银白色→①变灰暗→②变白色→③出现液滴→④白色固体,下列说法中正确的是 ( )
| A.①发生了氧化还原反应 | B.②变白色是因为生成了碳酸钠 |
| C.③是碳酸钠吸收空气中的水蒸气形成了溶液 | D.④只发生物理变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
如图所示,甲、乙、丙、丁分别代表Na2CO3、NaOH、NaHCO3、CO2四种物质,a、b、c、d、e、f分别表示两种物质间的转化关系。对于图中两种物质间的转化,通过一步反应就能实现的有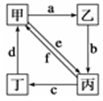
| A.只有a、b、c、d | B.只有b、c、d、e |
| C.只有c、d、e、f | D.a、b、c、d、e、f |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列有关物质用途的说法中,正确的是
| A.氨气是生产硝酸的重要原料 | B.甲烷与氯气反应可制得纯净的一氯甲烷 |
| C.铁制容器可用来盛放稀硝酸 | D.油脂经皂化反应可获得高级脂肪酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com