
某化学兴趣小组在探究卤素单质的氧化性的实验中发现,在足量的氯化亚铁溶液中,加入1~2滴溴水,振荡后溶液呈黄色,原因是什么?Br2能否氧化Fe2+,Fe3+与Br2谁的氧化性更强?
(1)甲同学认为:Br2不能氧化Fe2+,Fe3+的氧化性大于Br2,产生上述现象的原因不是化学反应所致,溶液呈黄色是含 (填化学式,下同)所致。
(2)乙同学认为:Br2将Fe2+氧化为Fe3+,Fe3+的氧化性小于Br2,产生上述现象的原因是化学反应所致,则溶液呈黄色是含 所致。
(3)丙同学为验证乙同学的观点,选择下列试剂,设计出两种方案进行实验,并通过观察实验现象,证明了乙同学的观点是正确的,供选用的试剂:a.酚酞试剂;b.CCl4;c.无水酒精;d.KSCN溶液。请你在下表中写出丙同学选用的试剂及实验中观察到的现象。(试剂填序号)
| 选用试剂 | 实验现象 |
| 方案1 | |
| 方案2 | |
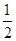 的Br-被氧化成单质Br2,则原FeBr2溶液的物质的量浓度是 。
的Br-被氧化成单质Br2,则原FeBr2溶液的物质的量浓度是 。  步步高达标卷系列答案
步步高达标卷系列答案科目:高中化学 来源: 题型:填空题
碘酸钾是一种白色结晶粉末,无臭无味,酸性条件下碘酸钾是一种较强的氧化剂,与氢碘酸、二氧化硫等还原性物质作用,被还原为单质碘,在碱性介质中,碘酸钾能被氯气、次氯酸盐等氧化为高碘酸钾。碘酸钾在常温下稳定,加热至560℃开始分解。工业生产碘酸钾的流程如下,在反应器中发生反应的化学方程式为:I2+KClO3+H2O--KH(IO3)2+KCl+Cl2 ↑(未配平)
(1)已知步骤①反应器发生的反应中,两种还原产物所得电子数相同,请配平该反应的化学方程式:______________________________________________________________;
(2)步骤②中,用稀酸酸化的作用是____________________________________________;
不选稀盐酸的原因是 ;
(3)步骤③要保持溶液微沸1小时以完全排出氯气,排出氯气的原因为 ;
(4)参照下表碘酸钾的溶解度,步骤11得到碘酸钾晶体,你建议的方法是 。
| 温度/℃ | 0 | 10 | 20 | 40 | 60 | 80 |
| KIO3g/100g水 | 4.60 | 6.27 | 8.08 | 12.6 | 18.3 | 24.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
(13分)我国是世界上发现和使用铜及铜器最早的国家之一,直到现在铜及其化合物在工农业生产中仍然有着广泛的应用。
(1)工业上可以用黄铜矿(主要成分CuFeS2)为原料冶炼铜。主要反应如下:
① 2CuFeS2+4O2=Cu2S+3SO2+2FeO ② 2Cu2S + 3O2=2SO2+2Cu2O③ Cu2S+ 2Cu2O="6Cu+" SO2
在③中被氧化与被还原元素原子的物质的量之比为 ;若由3mol CuFeS2生成3molCu,理论上消耗O2的物质的量为 。
(2)常温下Cu2O能溶于稀硫酸,得到蓝色溶液和红色固体,可以利用该性质检验工业上冶炼铜得到的粗铜中是否含有Cu2O,写出此反应的离子方程式 。
(3)刻蚀印刷电路的废液中含有大量的CuCl2、FeCl2、FeCl3,任意排放将导致环境污染和资源的浪费, 为了使FeCl3循环利用和回收CuCl2,现设计如下生产过程: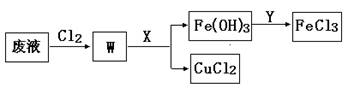
①试剂Y的名称 ;物质X最好是 (填化学式)。
②若常温下1L废液中含CuCl2、FeCl2、FeCl3的物质的量浓度均为0.5mol·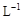 , 则加入Cl2气和物质X使溶液的pH在 范围时(设溶液体积保持不变),铁元素完全转化为Fe(OH)3,而CuCl2不产生沉淀。( KSP [Fe(OH)3]=1.0×10—38、 KSP[Cu(OH)2]=2.0×10—20 、 lg5=0.7)
, 则加入Cl2气和物质X使溶液的pH在 范围时(设溶液体积保持不变),铁元素完全转化为Fe(OH)3,而CuCl2不产生沉淀。( KSP [Fe(OH)3]=1.0×10—38、 KSP[Cu(OH)2]=2.0×10—20 、 lg5=0.7)
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(17分)黄铜矿是工业炼铜的主要原料,其主要成分为CuFeS2,现有一种天然黄铜矿(含少量脉石SiO2),为了测定该黄铜矿的纯度,某同学设计了如下实验:
称取研细的黄铜矿样品1.150g,在空气存在的条件下进行煅烧。实验后取d中溶液的1/10置于锥形瓶中,用0.05mo1/L标准碘溶液进行滴定,初读数为0.10mL,终读数如右上图所示。
(1)黄铜矿煅烧的反应为8CuFeS2+21O2高温8Cu+4FeO+2Fe2O3+16SO2,该反应中被还原的元素是___(填元素符号)。
(2)标准碘溶液应盛放在(填“碱式”或“酸式”)________滴定管中;装液之前,滴定管要用标准碘溶液润洗2—3次,润洗的操作是: 。请用化学方程式表示滴定的原理: 。
(3)滴定终点的读数为 mL;通过计算可知,该黄铜矿的纯度为 。
(4)若去掉c装置,会使测定结果 (填“偏低”“偏高”或“无影响”)。
(5)假设实验操作均正确,测得黄铜矿的纯度偏低,可能的原因主要有 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(10分)某研究性学习小组同学向Fe(NO3)3溶液中滴加淀粉KI溶液后,溶液呈蓝色。他们对Fe(NO3)3溶液中将I-氧化的氧化剂进行了如下探究:
【实验】分别向FeCl3溶液和HNO3溶液中滴加淀粉KI溶液后,发现溶液均显蓝色。
(1)FeCl3溶液与KI溶液反应的离子方程式为 。
(2)KI与HNO3反应的离子方程式为I-+H++NO3-→NO↑+I2+H2O(未配平),反应中氧化剂与还原剂的物质的量之比为 。
【提出假设】假设1:氧化剂只有Fe3+ 假设2:氧化剂只有NO3-(H+)
【设计实验方案,验证假设】
(3)请设计实验验证上述假设
供选试剂:0.2mol?L-1的Fe(NO3)3溶液、0.2mol?L-1的KI溶液、0.01mol?L-1的KMnO4酸性溶液、0.01mol?L-1的KSCN溶液、CCl4溶液、淀粉溶液。(提示:NO3-在不同条件下的还原产物较复杂,有时难以观察到气体产生)
| 实验步骤 | 预期现象和结论 |
| ①取5ml0.2mol?L-1的Fe(NO3)3溶液和5ml0.2mol?L-1的KI溶液,充分反应后加入5ml CCl4溶液,振荡静置,取上层溶液,分置于A、B两支试管中 | |
| ② ③ | 若溶液不变红色,则假设1成立,否则假设1不成立; 若溶液显紫色,则假设2成立,否则假设2不成立 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某研究小组对“Br2和I2能否将Fe2+氧化为Fe3+”这一课题进行实验和探究。请你完成相关问题的回答。
(1)提出合理的假设
假设1: Br2和I2都可以将Fe2+氧化为Fe3+;
假设2: Br2和I2都不能将Fe2+氧化为Fe3+;
假设3:
(2)实验验证
在大试管中加适量铁粉,加入10 mL 稀硫酸,振荡试管,充分反应后,铁粉有剩余,将所得的FeSO4溶液稀释到200mL,备用。
实验Ⅰ:向试管1中加入2 mL浅绿色的 FeSO4溶液,再滴加少量红棕色的溴水,振荡试管,溶液为黄色;
实验Ⅱ:向试管2中加入2 mL浅绿色的 FeSO4溶液,再滴加少量棕黄色的碘水,振荡试管,溶液为黄色。
(3)对实验现象的分析与讨论
①甲同学认为实验Ⅰ的现象说明溴水能将Fe2+氧化,离子方程式为 。
②乙同学认为应该补充实验,才能得出甲的结论。乙的实验操作以及预期现象是 。
③该小组同学对实验Ⅱ中溶液呈黄色的原因展开了讨论:
可能1:碘水与 FeSO4溶液不反应,黄色是碘水稀释后的颜色。
可能2: 。
丙同学和丁同学分别设计了以下实验方案以确定可能的原因。
丙方案:向试管2所得溶液中继续加入0.5mLCCl4,充分振荡,静置一段时间后。取出上层溶液,滴加几滴KSCN 溶液;
丁方案:向试管2所得溶液中继续加入加入0.5mL乙酸乙酯,充分振荡,静置一段时间后。取出下层溶液,滴加几滴KSCN 溶液;
你认为 方案为最佳方案,理由是 。
(4)拓展延伸
①为准确测定此实验所用的FeSO4溶液的浓度,某同学补充了以下实验:
滴定:量取20.00mL稀释后得到的溶液于锥形瓶中,将0.0200mol/LKMnO4标准溶液装入50mL中,滴定至终点,记录数据。重复滴定2次。平均消耗KMnO4溶液V mL。
②计算:此实验中所用的FeSO4溶液的物质的量浓度= mol/L(要求只列出算式,不需运算)。
(已知反应式:Fe2+ + MnO4- +H+ — Fe3+ + Mn2+ + H2O,未配平)
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
半导体生产中常需要控制掺杂,以保证控制电阻率,三氯化磷(PCl3)是一种重要的掺杂剂。实验室要用黄磷(即白磷)与干燥的Cl2模拟工业生产制取PCl3,装置如下图所示:(部分夹持装置略去)
A B C D E
已知黄磷与少量Cl2反应生成PCl3,与过量Cl2反应生成PCl5 PCl3遇水会强烈水解生成 H3PO3和HC1。遇O2会生成POCl3,POCl3溶于PCl3,PCl3、POCl3的熔沸点见下表:
| 物质 | 熔点/℃ | 沸点/℃ |
| PCl3 | -112 | 75.5 |
| POCl3 | 2 | 105.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某兴趣小组挤究SO2气体还原Fe3+、I2,他们使用的药品和装置如下图所示: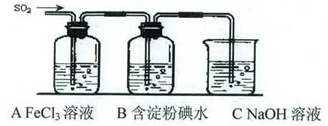
(1)SO2气体还原Fe3+反应的产物是_____________、_____________(填离子符号)。
(2)下列实验方案可以用于在实验室制取所需SO2的是____。
| A.Na2SO3溶液与HNO3 | B.Na2SO3固体与浓硫酸 |
| C.固体硫在纯氧中燃烧 | D.铜与热浓H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
纯碱和小苏打都是白色晶体,在日常生活中都可以找到。若要在家中将它们区分开来,下面的方法中可行的是
| A.分别放在炒锅中加热,观察是否有残留物 |
| B.分别用干净铁丝蘸取样品在煤气炉的火焰上灼烧,观察火焰颜色 |
| C.将样品溶解,分别加入澄清石灰水,观察是否有白色沉淀 |
| D.在水杯中各盛相同质量的样品,分别加入等体积的白醋,观察反应的剧烈程度 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com