
氮及其化合物与我们的吃、穿、住、行、健康等都有着密切的联系,也是高中化学学习中重要的一部分。请回答下列问题:
I.(1)现有一支15mL的试管,充满NO倒置于水槽中,向试管中缓缓通入一定量氧气,当试管内液面稳定时,剩余气体3mL。则通入氧气的体积可能为 。 (2)一定条件下,某密闭容器中发生反应:4NH3(g)+5O2(g) 4NO(g)+6H2O(g)。
(2)一定条件下,某密闭容器中发生反应:4NH3(g)+5O2(g) 4NO(g)+6H2O(g)。
| 起始浓度( mol/L) | C(NH3) | C(O2) | C(NO) | C(H2O) |
| 甲 | 1 | 2 | 0 | 0 |
| 乙 | 4 | 8 | 0 | 0 |
| 丙 | 0.2 | x | y | z |
 N2O4(g)△H<0。恒温恒容下反应相同时间后,分别测定体系中NO2的百分含量分别为a1和a2;已知T1< T2,则a1_ a2。
N2O4(g)△H<0。恒温恒容下反应相同时间后,分别测定体系中NO2的百分含量分别为a1和a2;已知T1< T2,则a1_ a2。14分)Ⅰ.(10分)(1)9mL和14.25mL(2分)
(2)①>(1分) ② 1,0.8,1.2(各1分)
(3)D(2分)
(4)c(NO-3)>c(H+)>c(NH+4)>c(OH-)(2分)
Ⅱ . (4分)
(1)3NF3+5H2O=9HF+2NO+HNO3(2分) 2:1 (1分)
(2)2.408×1023 或0.4NA(1分)(写成物质的是不给分)
解析试题分析:I.(1)4NO+3O2+2H2O=4HNO3,剩余气体3mL,过量气体可能是O2或NO,若是O2过量,NO全部参加反应,根据4NO~3O2,V(O2)= 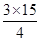 +3=14.25mL,若是NO过量,参加反应的NO为12ml,根据4NO~3O2,V(O2)=
+3=14.25mL,若是NO过量,参加反应的NO为12ml,根据4NO~3O2,V(O2)=  =9mL;
=9mL;
(2)①恒温恒容,乙中投料是甲中投料的4倍,等同于增大压强,平衡逆向移动,因此甲>乙;
②根据等效平衡可知,丙中转化为起始量与甲中的起始量相同,则
4NH3(g)+5O2g)?4NO(g)+6H2O(g),
起始1 2
丙 0.2 x y z
则0.2+y=1, x +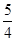 y =2 z =
y =2 z = 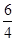 y
y
解得y =0.8,x=1,z=1.2;
(3)恒温恒容下反应相同时间,T1<T2,两个密闭容器中分别充入等量NO2,在T1下,达到平衡时,所用时间为t1,在T2时,在t1时间时已达到平衡,因为升高温度,平衡逆向移动,所以a1>a2,选择时间小于t1,在相同时间内,在T2时,尚未达到平衡,反应正向移动,则有a1小于或等于a2,故答案为:D;
(4)2.24L(标准状况)氨气被200 mL l mol/L HNO3溶液吸收后,得到硝酸铵和硝酸的混合溶液,且二者物质的量相等,二者中都含有NO3-,它浓度最大,NH4+水解,因此C(H+)>C(NH4+),C(OH-)最小,c(NO-3)>c(H+)>c(NH+4)>c(OH-);
Ⅱ.3NF3+5H2O=9HF+2NO+HNO3,NF3既是氧化剂又是还原剂,其中N化合价是+3价,体现氧化性有2mol降到+2价,体现还原性有1mol升到+5价,氧化剂和还原剂物质的量之比为2:1,反应中每有1mol硝酸生成,转移电子2mol,若反应中生成0.2mol HNO3,转移的电子数目为0.4NA。
考点:考查化学反应原理、盐的水解、氧化还原反应、方程式的书写


 英才计划期末调研系列答案
英才计划期末调研系列答案科目:高中化学 来源: 题型:填空题
水(H2O)在很多化学反应中有极其重要的作用。请研究下列水参与的氧化还原反应。
①NaH+H2O=NaOH+H2↑ ②2Na2O2+2H2O=4NaOH+O2↑
③2Na+2H2O="2NaOH" +H2↑ ④3NO2+H2O=2HNO3+NO↑
⑤2H2O 2H2↑+O2↑ ⑥2F2+2H2O=4HF+O2
2H2↑+O2↑ ⑥2F2+2H2O=4HF+O2
(1)水只作氧化剂的是 ;水只作还原剂的是 ;水既作氧化剂,又作还原剂的是 ;水既不作氧化剂,又不是还原剂的是 。
(2)水作氧化剂时,被还原的元素是 ,水作还原剂时,被氧化的元素是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
请将5种物质:N2O、FeCl2、Fe (NO3)3、HNO3和FeCl3分别填入下面对应的横线上,组成一个未配平的化学方程式。
(1)_________+__________→__________+__________+__________+H2O(不需配平)
(2)反应过程中,N2O与FeCl2的物质的量之比为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)请完成该反应的离子方程式:
C + MnO4- + H+ — CO2↑+ Mn2+ + H2O
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中。进行反应CO(g ) + H2O(g)  CO2(g) + H2(g)得到如下两组数据:
CO2(g) + H2(g)得到如下两组数据:
| 实验编号 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
 pC(g) ,在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如下表
pC(g) ,在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如下表| 压强p/Pa | 2×105 | 5×105 | 1×106 |
| c(A)/mol·L-1 | 0.08 | 0.20 | 0.44 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
已知:氧化性:KMnO4>HNO3;Bi位于周期表中VA族,+3价较稳定,Bi2O3为碱性氧化物,Bi3+的溶液为无色。取一定量硝酸酸化的Mn(NO3)2溶液依次进行下列实验,现象记录如下:
① 向其中加入适量的NaBiO3,溶液变为紫红色。② 继续滴加适量H2O2,紫红色褪去,并有气泡产生。③ 再加入适量的PbO2固体,固体溶解,溶液又变为紫红色。
回答下列问题:
(1)写出实验①反应的离子方程式:______________________________________。
(2)KMnO4、H2O2、PbO2氧化性由强到弱的顺序为____________________________。
(3)向反应③得到的溶液中通入SO2气体,看到的现象是____________________________。
(4)若实验②放出了336mL气体(标准状况),则反应①被氧化的Mn(NO3)2为________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某体系中存在如下反应:
①H2S+4H2O-8e → SO42-+10H+
②2IO3-+12 H++10e → I2+6H2O
(1)反应①中H2S做__________剂,反应②属于___________ 反应(填“氧化”或“还原”)。
(2)若在反应①中失去0.2 mol 电子,则反应②中可生成 g I2。
(3)写出并配平碘酸钾与硫化氢反应的化学方程式,同时标出电子转移的方向和数目:
_______________________________________________________________________。
(4)由上述反应可推知 。
a.氧化性:K2SO4> KIO3 b.酸性:HIO3> H2SO4
c.还原性:H2S > I2 d.反应过程中溶液的酸性逐渐减弱
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
已知氮元素有许多化合价,其化合价有-3、0、+1、+2、+3、+4、+5
(1)下表是硝酸与某种金属M在某些条件下反应所得还原产物的关系: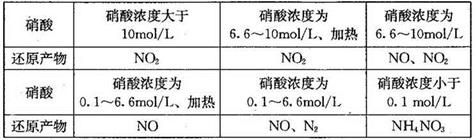
通过分析上表可得出的结论是:当硝酸与金属M反应时,________________。
金属锌与某浓度的硝酸反应时,无气体产生,则此化学反应中被还原的硝酸与参加反应的硝酸物质的量之比是________。
(2)以氨作为燃料的固体氧化物(含有O2-)燃料电池,具有全固态结构、能量效率高、无污染等特点,另外氨气含氢量高,不含碳,易液化,方便运输和贮存,是很好的氢源载体。其工作原理如图所示: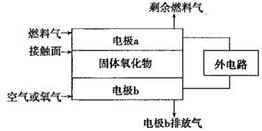
①该电池工作时的总反应为______ __
②固体氧化物作为电池工作的电解质,O2-移动方向为________(选填“由电极a向电极b”或“由电极b向电极a”)。
③该电池工作时,在接触面上发生的电极反应为________。
(3)N2O5是一种新型硝化剂,其性质和制备 受到人们的关注。如图所示装置可用于制备N2O5,写出在电解池中生成N2O5的电极反应式________________。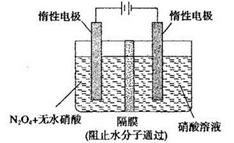
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
(10分)将1.52g铜镁合金完全溶解于50.0mL密度为1.40g/mL、质量分数为63.0%的浓硝酸中,得到NO2和N2O4的混合气体1120mL (标准状况),向反应后的溶液中加入1.00mol/LNaOH溶液,当金属离子全部沉淀时,得到2.54g沉淀。求:
(1)浓硝酸中HNO3的物质的量浓度。
(2)该合金中铜与镁的物质的量之比为 。
(3) NO2和N2O4的混合气体中,NO2的体积分数是 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某兴趣小组探究SO2气体还原Fe3+、I2,他们使用的药品和装置如下图所示: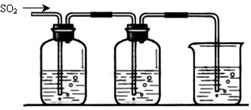
FeCl3溶液 含有淀粉的碘水 NaOH溶液
A B C
(1)在配制氯化铁溶液时,需先把氯化铁晶体溶解在 中,再加水稀释,这样操作的目的是 。
(2)装置C的作用是 。
(3)若要从A中所得溶液提取晶体,必须进行的实验操作步骤:蒸发、冷却结晶、 、自然干燥,在这一系列操作中没有用到的仪器有 (填序号)。
| A.蒸发皿 |
| B.石棉网 |
| C.漏斗 |
| D.烧杯 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com