
【题目】下列离子方程式书写正确的是( )
A.向稀硫酸中加入![]() 溶液:
溶液:![]()
B.往![]() 溶液中加入过量NaOH溶液并加热:
溶液中加入过量NaOH溶液并加热:![]()
C.将少量![]() 通入次氯酸钙溶液中:
通入次氯酸钙溶液中:![]()
D.将足量![]() 通入
通入![]() 溶液中:
溶液中:![]()
【答案】A
【解析】
A.向稀硫酸中加入CH3COONa溶液,反应生成硫酸钠和醋酸,反应的离子方程式为:CH3COO-+H+=CH3COOH,选项A正确;
B.往NH4HCO3溶液中加入过量NaOH溶液并加热,反应生成碳酸钠、氨气和水,正确的离子方程式为:NH4++HCO3-+2OH-![]() NH3↑+2H2O+CO32-,选项B错误;
NH3↑+2H2O+CO32-,选项B错误;
C.ClO-有较强的氧化性,而在水溶液中SO2有较强的还原性,二者相遇首先发生氧化还原反应,同时生成硫酸钙沉淀,正确的离子方程式为:SO2+3ClO-+Ca2++H2O=CaSO4↓+Cl-+2HClO,选项C错误;
D.将足量Cl2通入FeBr2溶液中,反应生成氯化铁和溴,正确的离子方程式为:2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-,选项D错误;
答案选A。


科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,表中所列的字母分别代表一种化学元素。

(1)请写出元素d的基态原子电子排布式______________________________________________________。
(2)b元素的氧化物中b与氧元素之间的共价键类型是_________________。(填“极性键”、“非极性键”)其中b原子的杂化方式是________。
(3)a单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。

若已知a的原子半径为d,NA代表阿伏加德罗常数,a的相对原子质量为Mr,则一个晶胞中a原子的数目为________,该晶体的密度为 _______________________________(用字母表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】俗称“一滴香”的物质被人食用后会损伤肝脏,还能致癌.“一滴香”的分子结构如图所示,下列说法正确的是( )

A.该有机物的分子式为C8H8O3
B.1mo1该有机物最多能与2molH2发生加成反应
C.该有机物能发生取代、加成和氧化反应
D.该有机物能与碳酸氢钠反应生成CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活密切相关,下列说法正确的是( )
A.氢氧化铝胶体可用来对自来水净化和杀菌消毒
B.“血液透析”利用了胶体丁达尔效应
C.BaSO4常用来作胃镜中的“钡餐”
D.为了消除碘缺乏病,在食用盐中加入一定量的碘单质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中所含离子的浓度如下表,则a值为
离子 | NO3- | SO42- | H+ | Mg2+ | K+ |
浓度(mol/L) | 0.3 | 0.4 | 0.2 | 0.2 | a |
A. 0.1 B. 0.3 C. 0.5 D. 0.7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨的热化学方程式为:N2(g)+3H2(g) ![]() 2NH3(g) ΔH=-92.4 kJ·mol-1。现将1 mol N2(g)、3 mol H2(g)充入一容积为2 L的密闭容器中,在500 ℃下进行反应,10 min时达到平衡,NH3的体积分数为,下列说法中正确的是( )
2NH3(g) ΔH=-92.4 kJ·mol-1。现将1 mol N2(g)、3 mol H2(g)充入一容积为2 L的密闭容器中,在500 ℃下进行反应,10 min时达到平衡,NH3的体积分数为,下列说法中正确的是( )


A. 若达到平衡时,测得体系放出9.24 kJ热量,则H2反应速率变化曲线如图a所示
B. 反应过程中,混合气体平均相对分子质量为M,混合气体密度为d,混合气体压强为p,三者的变化趋势如图b
C. 如图c所示,容器Ⅰ和Ⅱ达到平衡时,NH3的体积分数为,则容器Ⅰ放出热量与容器Ⅱ吸收热量之和为92.4 kJ
D. 若起始加入物料为1 mol N2、3 mol H2,在不同条件下达到平衡时,NH3的体积分数变化如图d所示
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】雾霾天气严重影响人们的生活,汽车尾气所排放的氮氧化物及燃煤所排放的硫氧化物是造成雾霾的重要原因。
(1)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。反应原理如图所示:

如图是不同催化剂Mn和Cr在不同温度下对应的脱氮率,由图可知工业使用的最佳的催化剂和相应的温度分别为________________。

(2)改善能源结构是治理雾霾问题的最直接有效途径。二甲醚是一种清洁能源,可用合成气在催化剂存在下制备二甲醚,其反应原理为:
2CO(g)+4H2(g)![]() CH3OCH3 (g)+H2O(g) ΔH
CH3OCH3 (g)+H2O(g) ΔH
已知在一定条件下,该反应中CO的平衡转化率α随温度、投料比![]() 的变化曲线如图3所示。
的变化曲线如图3所示。

① a、b、c按由大到小的顺序排序为_______________;ΔH_____0(填“>”“<”或“=”)。
② 对于气相反应,用某组分(B)的平衡分压p(B)代替物质的量浓度c(B)也可以表示平衡常数(记作Kp),则该反应平衡常数的表达式Kp=_________________________。
③ 在恒容密闭容器里按体积比为1∶2充入一氧化碳和氢气,一定条件下反应达到平衡状态。当改变反应的某一个条件后,下列变化能说明平衡一定向逆反应方向移动的是_____。
A.一氧化碳的转化率减小
B.容器的压强增大
C.化学平衡常数K值减小
D.逆反应速率先增大后减小
E.混合气体的密度增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有反应4HCl(g)+O2(g)═2Cl2(g)+2H2O(g),已知2 mol O2被还原时,放出a kJ的热量,且知断开1 mol O=O键需要吸收b kJ的热量,断开1 mol Cl—Cl键需要吸收c kJ的热量。则断开1 mol H—O键比断开1 mol H—Cl键所需能量高
A. (b-a-2c)/4kJB. (a+2b-4c)/8kJC. (a+b-2c)/4kJD. (2b-a-4c)/8kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、D为常见单质,各物质发生如下框图所示变化,回答下列问题:
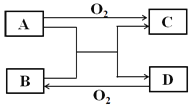
(1)若A、D为短周期同主族非金属元素的单质,则A元素在周期表中的位置为______,D的晶体类型是______,请写出A+B→C+D的化学方程式______。
(2)若B为气体,其标准状况下密度为1.964gL-1,C为白色固体,可用来制作耐高温材料。则B的电子式为______,C中含有的化学键是______(填写“离子键或者共价键”)。
(3)若A为生产生活中用量最大的金属,B在常温下为无色液体,写出C(金属元素有两种不同化合价)与盐酸反应的离子反应方程式____________。若以A和石墨棒为电极,NaCl溶液为电解质溶液构成原电池,请写出石墨电极的电极反应式______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com