
【题目】已知A、D为常见单质,各物质发生如下框图所示变化,回答下列问题:
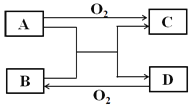
(1)若A、D为短周期同主族非金属元素的单质,则A元素在周期表中的位置为______,D的晶体类型是______,请写出A+B→C+D的化学方程式______。
(2)若B为气体,其标准状况下密度为1.964gL-1,C为白色固体,可用来制作耐高温材料。则B的电子式为______,C中含有的化学键是______(填写“离子键或者共价键”)。
(3)若A为生产生活中用量最大的金属,B在常温下为无色液体,写出C(金属元素有两种不同化合价)与盐酸反应的离子反应方程式____________。若以A和石墨棒为电极,NaCl溶液为电解质溶液构成原电池,请写出石墨电极的电极反应式______。
【答案】第二周期第IVA族 原子晶体 SiO2+2C![]() Si+2CO
Si+2CO ![]() 离子键 Fe3O4+8H+=Fe2++2Fe3++4H2O O2+2H2O+4e-=4OH-
离子键 Fe3O4+8H+=Fe2++2Fe3++4H2O O2+2H2O+4e-=4OH-
【解析】
(1)若A、D为短周期同主族非金属元素的单质,由转化可知B、C属于氧化物,A与B的反应属于置换反应,可推知A为碳、B为SiO2、C为CO、D为Si,则A元素在周期表中的位置为:第二周期第IVA族,硅的晶体类型是原子晶体,A+B→C+D的化学方程式:SiO2+2C![]() Si+2CO;
Si+2CO;
(2)若B为气体,其标准状况下密度为1.964gL-1,B的相对分子质量=22.4×1.964=44,C为白色固体,可用来制作耐高温材料,则A为Mg、B为CO2、C为MgO、D为碳,B的电子式为![]() ,C(MgO)中含有的化学键是:离子键;
,C(MgO)中含有的化学键是:离子键;
(3)若A为生产生活中用量最大的金属,B在常温下为无色液体,则A为Fe、B为H2O、C为Fe3O4、D为H2,C与盐酸反应的离子反应方程式:Fe3O4+8H+=Fe2++2Fe3++4H2O,若以Fe和石墨棒为电极,NaCl溶液为电解质溶液构成原电池,石墨电极为正极,发生还原反应,氧气获得电子市场氢氧根离子,电极反应式为:O2+2H2O+4e-=4OH-。


科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A.向稀硫酸中加入![]() 溶液:
溶液:![]()
B.往![]() 溶液中加入过量NaOH溶液并加热:
溶液中加入过量NaOH溶液并加热:![]()
C.将少量![]() 通入次氯酸钙溶液中:
通入次氯酸钙溶液中:![]()
D.将足量![]() 通入
通入![]() 溶液中:
溶液中:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘是人体必需元素之一,海洋植物含有丰富的碘元素。在实验中,从海藻里提取碘的流程如下:

(1)上图为海藻制碘的流程图。步骤①灼烧海藻时,除需要三脚架外,还需要用到的实验仪器是_____________________(从下列仪器中选出所需的仪器,用标号字母填写)。
A.烧杯 B.坩埚 C.表面皿 D.泥三角 E.酒精灯 F.冷凝管
(2)步骤③的名称为_____________,步骤⑤所需玻璃仪器除烧杯外还需___________________。
(3)步骤④中若不用氯气,可以选择滴加稀硫酸,再加入H2O2的方法,则反应的离子方程式为______________________________________。
(4)步骤⑤,可选择的有机试剂是___________。
A.甲苯、酒精 B.四氯化碳、苯 C.汽油、乙酸 D.汽油、甘油
(5)欲检验提取碘后的水溶液中是否含有单质碘的简单化学方法为_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图表示由不同化学元素组成的化合物,以下说法正确的是( )

A. 若图中①为某种多聚体的单体,则①最可能是核苷酸
B. 若②存在于皮下和内脏器官周围等部位,则②可能是胆固醇
C. 若③为多聚体,且是细菌的遗传物质,则③是RNA
D. 若④主要在人体肝脏和肌肉内合成,则④最可能是糖原
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:NOx能与Na2O2反应;NO和NO2均能与酸性KMnO4溶液反应生成NO3ˉ和Mn2+。
I.用下图所示装置(略去夹持仪器)可制得少量亚硝酸钠(2NO+Na2O2=2NaNO2)。

(1)B、D的仪器名称是________,D的作用是________。
(2)通NO前,需先通一段时间N2,目的是________,
(3)E中主要反应的离子方程式为________,
(4)常温下,测得实验前后C的质量差值为0.30g,则制得NaNO2________g。
Ⅱ.NO2和Na2O2都有较强氧化性,为探究NO2与Na2O2反应的产物,提出如下假设:
假设i.NO2氧化Na2O2;假设ii.Na2O2氧化NO2。
甲同学设计如图所示实验装置:

请回答下列问题:
(5)单向阀在实现气体单向流通的同时,还有一个作用是___________。
(6)待试管G中收集满气体,向试管G中加入适量Na2O2粉末,塞紧塞子,轻轻振荡试管内粉末,观察到红棕色气体迅速消失;再将带火星的木条迅速伸进试管内,木条复燃,甲同学据此认为假设i正确。乙同学认为该装置不能达到实验目的,为达到实验目的,应在F、G之间增加一个M装置,M中应盛装__________(可供选择的试剂:碱石灰,浓硫酸饱和氯化钠溶液);乙同学用改进后的装置,重复了甲同学的实验操作,观察到红棕色气体迅速消失,带火星的木条未复燃。得到结论:假设ⅱ正确。
请做出正确判断,写出NO2和Na2O2反应的化学方程式__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液能与铝作用生成氢气,则溶液中一定大量共存的离子组是( )
A.Na+、Ba2+、Mg2+、Cl-
B.Cl-、HCO3-、Ca2+、K+
C.NO3-、SO42-、K+、Fe2+
D.Na+、Ba2+、Cl-、Br-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,用化学用语回答下列问题:
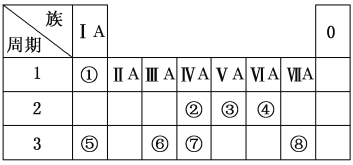
(1)②、④元素的原子按1∶2组成化合物的电子式:(用元素符号表示)_________________。
(2)⑤、⑧元素的化合物的用电子式表示形成过程:___________________________。
(3)①、⑤、⑥阳离子氧化性由弱到强的顺序是(用离子符号表示)_____________。
(4)①、④、⑤中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:________________。
(5)由表中两种元素的原子按1∶1组成的常见液态化合物的稀溶液易被催化分解,可使用的催化剂为(填序号)________。
a.MnO2 b.FeCl3 c.Na2SO3 d.KMnO4
(6)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:
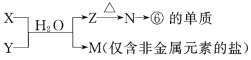
X溶液与Y溶液反应的离子方程式为___________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素A、B、C、D的原子序数依次增大。X、Y、Z、W分别是由这四种元素中的两种组成的常见化合物,Y为淡黄色固体,W为常见液体;甲为单质,乙为红棕色气体;上述物质之间的转化关系如图所示(部分生成物已省略)。则下列说法中正确的是
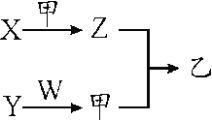
A. 沸点:W>X
B. 原子半径:D>C>B>A
C. C、D两种元素组成的化合物只含有离子键
D. A、B、C三种元素组成的化合物均为共价化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活息息相关。下列说法正确的是
A.矿泉水中不含任何化学物质B.聚乙烯不能使酸性高锰酸钾溶液褪色
C.碳酸钡可用作医疗上的“钡餐”D.氢氧化钠可用作治疗胃酸过多的药物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com