
【题目】图表示由不同化学元素组成的化合物,以下说法正确的是( )

A. 若图中①为某种多聚体的单体,则①最可能是核苷酸
B. 若②存在于皮下和内脏器官周围等部位,则②可能是胆固醇
C. 若③为多聚体,且是细菌的遗传物质,则③是RNA
D. 若④主要在人体肝脏和肌肉内合成,则④最可能是糖原
【答案】D
【解析】
化合物的元素组成:
(1)蛋白质是由C、H、O、N元素构成,有些含有P、S;
(2)核酸是由C、H、O、N、P元素构成;
(3)脂质是由C、H、O构成,有些含有N、P;
(4)糖类是由C、H、O组成.
①的组成元素是C、H、O、N,最可能是蛋白质或氨基酸;②和④的组成元素只有C、H、O,可能是糖类或脂肪;③的组成元素是C、H、O、N、P,可能是ATP、磷脂或核酸。
①的组成元素是C、H、O、N,所以①最可能是组成蛋白质的氨基酸,A错误;②的组成元素只有C、H、O,且存在于皮下和内脏器官周围等部位,可能是脂肪,B错误;③的组成元素是C、H、O、N、P,且是细菌的遗传物质,所以③是DNA,C错误;④的组成元素只有C、H、O,且在肝脏和肌肉中贮能,可能是糖原,D正确,故选D。


科目:高中化学 来源: 题型:
【题目】化学与生活密切相关,下列说法正确的是( )
A.氢氧化铝胶体可用来对自来水净化和杀菌消毒
B.“血液透析”利用了胶体丁达尔效应
C.BaSO4常用来作胃镜中的“钡餐”
D.为了消除碘缺乏病,在食用盐中加入一定量的碘单质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有反应4HCl(g)+O2(g)═2Cl2(g)+2H2O(g),已知2 mol O2被还原时,放出a kJ的热量,且知断开1 mol O=O键需要吸收b kJ的热量,断开1 mol Cl—Cl键需要吸收c kJ的热量。则断开1 mol H—O键比断开1 mol H—Cl键所需能量高
A. (b-a-2c)/4kJB. (a+2b-4c)/8kJC. (a+b-2c)/4kJD. (2b-a-4c)/8kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯酚是一种重要的化工原料。以苯酚为主要起始原料,经下列反应可制得香料M和高分子化合物N.(部分产物及反应条件已略去)

(1)B的官能团的名称是_______________。
(2)已知C的分子式为C5H12O,C能与金属Na反应,C的核磁共振氢谱有3组峰,则C的结构简式 ______________________。
(3)由D生成N的反应类型是_________,B与C反应生成M的反应类型是_________。
(4)写出M与NaOH溶液反应的化学方程式是__________________________________。
(5)物质F的结构是: ,则符合下列条件的F的同分异构体有 ______种。
,则符合下列条件的F的同分异构体有 ______种。
①能发生银镜反应 ②能与NaHCO3溶液反应 ③分子中有苯环,无 结构。其中苯环上只有两个取代基,且核磁共振氢谱有4组峰,峰面积之比为1:2:2:1的为___________(写结构简式)。
结构。其中苯环上只有两个取代基,且核磁共振氢谱有4组峰,峰面积之比为1:2:2:1的为___________(写结构简式)。
(6)已知: ,写出以苯酚、乙醇和ClCH2COOH为原料制备
,写出以苯酚、乙醇和ClCH2COOH为原料制备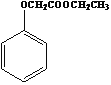 的合成路线流程图(无机试剂任用)。___________
的合成路线流程图(无机试剂任用)。___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.金属元素在不同的化合物中化合价均相同
B.所有合金都只含有金属元素
C.可利用铝热反应冶炼单质镁
D.电解熔融氯化钠可以制得金属钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、D为常见单质,各物质发生如下框图所示变化,回答下列问题:
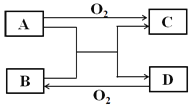
(1)若A、D为短周期同主族非金属元素的单质,则A元素在周期表中的位置为______,D的晶体类型是______,请写出A+B→C+D的化学方程式______。
(2)若B为气体,其标准状况下密度为1.964gL-1,C为白色固体,可用来制作耐高温材料。则B的电子式为______,C中含有的化学键是______(填写“离子键或者共价键”)。
(3)若A为生产生活中用量最大的金属,B在常温下为无色液体,写出C(金属元素有两种不同化合价)与盐酸反应的离子反应方程式____________。若以A和石墨棒为电极,NaCl溶液为电解质溶液构成原电池,请写出石墨电极的电极反应式______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温恒容下,向2L密闭容器中加入MgSO4和CO(g),发生反应:
MgSO4(s)+CO(g)![]() MgO(s)+CO2(g)+SO2(g),反应过程中测定的部分数据见下表:
MgO(s)+CO2(g)+SO2(g),反应过程中测定的部分数据见下表:
反应时间/min | n(MgSO4)/mol | n(CO)/mol | n(CO2)/mol |
0 | 2.00 | 2.00 | 0 |
2 | 0.80 | ||
4 | 1.20 |
下列说法正确的是
A. 反应在0~2min内的平均速率为v(SO2)=0.6mol·L-1·min-1
B. 反应在2~4min内容器内气体的密度没有变化
C. 若升高温度,反应的平衡常数变为1.00,则正反应为放热反应
D. 保持其他条件不变,起始时向容器中充入1.00molMgSO4和1.00molCO,到达平衡时n(CO2)>0.60mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com