
【题目】下列变化过程中,画横线的元素被氧化的是( )
A. CO2→CO B. FeCl3→FeCl2
C. HCl→AgCl D. KI→I2
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】已知高能锂离子电池的总反应式为2Li+FeS=Fe+Li2S,LiPF6·SO(CH3)2为电解质,用该电池为电源电解含镍酸性废水并得到单质Ni的实验装置如图所示。下列说法不正确的是

A. 电极Y为Li
B. 电解过程中,b中NaCl溶液的物质的量浓度将不断减小
C. X极反应式为FeS+2Li++2e-=Fe+Li2S
D. 若将图中阳离子膜去掉,将a、b两室合并,则电解反应总方程式发生改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘是人体必需元素之一,海洋植物含有丰富的碘元素。在实验中,从海藻里提取碘的流程如下:

(1)上图为海藻制碘的流程图。步骤①灼烧海藻时,除需要三脚架外,还需要用到的实验仪器是_____________________(从下列仪器中选出所需的仪器,用标号字母填写)。
A.烧杯 B.坩埚 C.表面皿 D.泥三角 E.酒精灯 F.冷凝管
(2)步骤③的名称为_____________,步骤⑤所需玻璃仪器除烧杯外还需___________________。
(3)步骤④中若不用氯气,可以选择滴加稀硫酸,再加入H2O2的方法,则反应的离子方程式为______________________________________。
(4)步骤⑤,可选择的有机试剂是___________。
A.甲苯、酒精 B.四氯化碳、苯 C.汽油、乙酸 D.汽油、甘油
(5)欲检验提取碘后的水溶液中是否含有单质碘的简单化学方法为_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图表示由不同化学元素组成的化合物,以下说法正确的是( )

A. 若图中①为某种多聚体的单体,则①最可能是核苷酸
B. 若②存在于皮下和内脏器官周围等部位,则②可能是胆固醇
C. 若③为多聚体,且是细菌的遗传物质,则③是RNA
D. 若④主要在人体肝脏和肌肉内合成,则④最可能是糖原
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:NOx能与Na2O2反应;NO和NO2均能与酸性KMnO4溶液反应生成NO3ˉ和Mn2+。
I.用下图所示装置(略去夹持仪器)可制得少量亚硝酸钠(2NO+Na2O2=2NaNO2)。

(1)B、D的仪器名称是________,D的作用是________。
(2)通NO前,需先通一段时间N2,目的是________,
(3)E中主要反应的离子方程式为________,
(4)常温下,测得实验前后C的质量差值为0.30g,则制得NaNO2________g。
Ⅱ.NO2和Na2O2都有较强氧化性,为探究NO2与Na2O2反应的产物,提出如下假设:
假设i.NO2氧化Na2O2;假设ii.Na2O2氧化NO2。
甲同学设计如图所示实验装置:

请回答下列问题:
(5)单向阀在实现气体单向流通的同时,还有一个作用是___________。
(6)待试管G中收集满气体,向试管G中加入适量Na2O2粉末,塞紧塞子,轻轻振荡试管内粉末,观察到红棕色气体迅速消失;再将带火星的木条迅速伸进试管内,木条复燃,甲同学据此认为假设i正确。乙同学认为该装置不能达到实验目的,为达到实验目的,应在F、G之间增加一个M装置,M中应盛装__________(可供选择的试剂:碱石灰,浓硫酸饱和氯化钠溶液);乙同学用改进后的装置,重复了甲同学的实验操作,观察到红棕色气体迅速消失,带火星的木条未复燃。得到结论:假设ⅱ正确。
请做出正确判断,写出NO2和Na2O2反应的化学方程式__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,用化学用语回答下列问题:
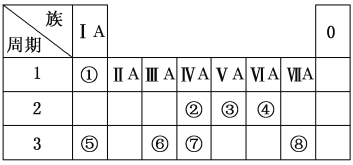
(1)②、④元素的原子按1∶2组成化合物的电子式:(用元素符号表示)_________________。
(2)⑤、⑧元素的化合物的用电子式表示形成过程:___________________________。
(3)①、⑤、⑥阳离子氧化性由弱到强的顺序是(用离子符号表示)_____________。
(4)①、④、⑤中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:________________。
(5)由表中两种元素的原子按1∶1组成的常见液态化合物的稀溶液易被催化分解,可使用的催化剂为(填序号)________。
a.MnO2 b.FeCl3 c.Na2SO3 d.KMnO4
(6)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:
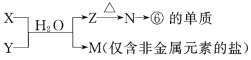
X溶液与Y溶液反应的离子方程式为___________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳是形成化合物种类最多的元素,其单质及化合物是人类生产生活的主要能源物质。请回答下列问题:
(1)有机物M经过太阳光光照可转化成N,转化过程如下:

则M、N相比,较稳定的是____________。
(2)已知CH3OH(l)的燃烧热为726.5kJ·mol-1,CH3OH(l) + 1/2O2(g) ═ CO2(g) + 2H2O(g)
△H=-akJ·mol-1,则a_____726.5(填“>”、“<”或“=”)。
(3)使Cl2和H2O(g)通过灼热的炭层,生成HCl和CO2,当有1molCl2参与反应时释放出145kJ热量,写出该反应的热化学方程式_______________________。
(4)火箭和导弹表面的薄层是耐高温物质。将石墨、铝粉和二氧化钛按一定比例混合在高温下煅烧,所得物质可作耐高温材料,4Al(s)+3TiO2(s)+3C(s)═2Al2O3(s)+3TiC(s) △H=-1176kJ·mol-1,则反应过程中,每转移1mol电子放出的热量为_________________。
(5)已知:Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g) △H=+489.0kJ·mol-1
CO(g)+1/2O2(g)=CO2(g) △H=-283.0kJ·mol-1
C(石墨)+O2(g) =CO2(g) △H=-393.5kJ·mol-1
则4Fe(s)+3O2(g)=2Fe2O3(s) △H=______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com