
【题目】恒温恒容下,向2L密闭容器中加入MgSO4和CO(g),发生反应:
MgSO4(s)+CO(g)![]() MgO(s)+CO2(g)+SO2(g),反应过程中测定的部分数据见下表:
MgO(s)+CO2(g)+SO2(g),反应过程中测定的部分数据见下表:
反应时间/min | n(MgSO4)/mol | n(CO)/mol | n(CO2)/mol |
0 | 2.00 | 2.00 | 0 |
2 | 0.80 | ||
4 | 1.20 |
下列说法正确的是
A. 反应在0~2min内的平均速率为v(SO2)=0.6mol·L-1·min-1
B. 反应在2~4min内容器内气体的密度没有变化
C. 若升高温度,反应的平衡常数变为1.00,则正反应为放热反应
D. 保持其他条件不变,起始时向容器中充入1.00molMgSO4和1.00molCO,到达平衡时n(CO2)>0.60mol
【答案】BD
【解析】试题分析:A、前2分钟一氧化碳的物质的量变化量为2-0.08=0.12摩尔,根据方程式分析二氧化硫的物质的量的变化量为0.12摩尔,所以速率=2.00-0.08/2/2=0.3 mol·L-1·min-1错误,不选A;B、由方程式分析,前2分钟二氧化碳的变化量也为1.2摩尔,即2分钟反应到平衡,所以2到4分钟都处于平衡状态,气体的密度没有变化,正确,选B;C、由表中数据计算:
MgSO4(s)+CO(g)![]() MgO(s)+CO2(g)+SO2(g)
MgO(s)+CO2(g)+SO2(g)
起始物质的量 2.0 0 0
改变的物质的量 1.2 1.2 1.2
平衡物质的量 0.8 1.2 1.2
所以该温度下平衡常数K=(1.2/2)*(1.2/2)/(0.8/2)=0.9,若升温,反应的平衡常数变为1.00,说明平衡向正向移动,正反应为吸热反应,错误,不选C;D、保持其他条件不变,起始时向容器中冲入1.0摩尔的硫酸镁和1.00摩尔的一氧化碳,等效于原平衡体积增大一倍,降低压强,平衡向正方向移动,所以到平衡时,二氧化碳的物质的量大于0.60摩尔,正确,选D。


科目:高中化学 来源: 题型:
【题目】NaCl溶液中混有Na2SO4、CaCl2溶液和淀粉胶体,选择适当的试剂和方法从中提纯出NaCl晶体.相应的实验过程如图: 
(1)写出实验过程中所用试剂(写化学式):
试剂①;试剂③ .
(2)判断试剂①已过量的方法是: .
(3)用离子方程式表示加入试剂②的作用:
(4)操作①是利用半透膜进行分离提纯.
操作①的实验结果:淀粉(填“能”或“不能”)透过半透膜;SO42﹣(填“能”或“不能”)透过半透膜.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学反应与能量的说法正确的是
A.酸碱中和是放热反应
B.炭在氧气中燃烧属于吸热反应
C.化学键的形成需吸收能量
D.化学反应过程中,化学能一定转化成热能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 增大压强或升高温度,—定能使化学反应速率加快
B. 己知 Ni(CO)4(g)=Ni(s)+4CO(g) △H=QkJ/mol,则 Ni(s) +4CO(g)=Ni(CO)4(g) △H=-QkJ/mol
C. 500°C、30 MPa下, 0.5 mol N2(g)和1.5mol H2(g)反应生成NH3(g) 放热QkJ,其热化学方程式为N2(g)+3 H2(g)![]() 2 NH3(g) △H=-2QkJ/mol
2 NH3(g) △H=-2QkJ/mol
D. 己知两个平衡体系:2NiO(s)![]() 2Ni(s)+O2(g) 2CO(g)+O2(g)
2Ni(s)+O2(g) 2CO(g)+O2(g)![]() 2CO2(g)是平衡常数分别为K1和K2,可推知平衡NiO(s)+CO(g)
2CO2(g)是平衡常数分别为K1和K2,可推知平衡NiO(s)+CO(g)![]() Ni(s)+CO2(g)的平衡常数为
Ni(s)+CO2(g)的平衡常数为![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.二氧化碳的相对分子质量是44 B.“物质的量浓度”可简称为“量浓度”
C.阿伏加德罗常数的单位是mol-1 D.1 mol任何物质所占体积都是22.4 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究NO2、SO2、CO等大气污染气体的测量及处理具有重要意义。
(1)降低汽车尾气的方法之一是在排气管上安装催化转化器,发生如下反应:
2NO(g)+2CO(g)![]() N2(g)+2CO2(g) △H<0
N2(g)+2CO2(g) △H<0
①一定条件下,将体积比为1:2的NO、CO气体置于恒容密闭容器中发生上述反应,下列能说明反应达到平衡状态的是_________(填字母)。
A.体系压强保持不变 B.混合气体颜色保持不变
C. N2和CO2的体积比保持不变 D. v正(CO)=2v逆(N2)
②20min时,若改变反应条件,导致N2浓度发生如下图1所示的变化,则改变的条件可能是_____(填字母)。
A.加入催化剂 B.降低温度 C.增加CO2量 D.缩小容器体积
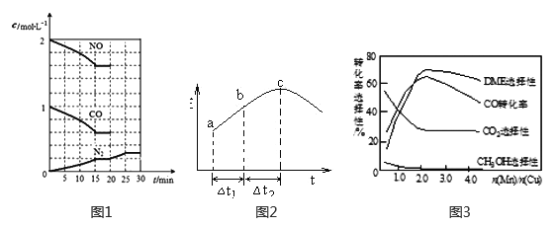
(2)在一定条件下,将SO2和NO2通入绝热恒容密闭容器中,发生反应:SO2(g)+NO2(g) ![]() SO3(g)+NO(g),正反应速率随时间变化如图2所示。由图可得出的正确结论是_____________(填字母)。
SO3(g)+NO(g),正反应速率随时间变化如图2所示。由图可得出的正确结论是_____________(填字母)。
A.反应在c点达到平衡状态
B.反应物浓度:b点小于c点
C.反应物的总能量低于生成物的总能量
D.△t1=△t2 时,SO2的转化率:a~b段小于b~c段
(3)采用一种新型的催化剂(主要成分是Cu-Mn的合金),利用CO和H2可制备二甲醚(DME)。观察图3回答问题。催化剂中n(Mn)/n(Cu)约为__________时最有利于二甲醚的合成。
(4)工业上可以用CO和H2生产燃料甲醇:CO(g)+2H2(g)![]() CH3OH(g) △H=-92.9kJ/mol, 300℃,在容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡的有关数据如下:
CH3OH(g) △H=-92.9kJ/mol, 300℃,在容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡的有关数据如下:
容器 | 甲 | 乙 | 丙 | |
反应物投入量 | 1molCO、2molH2 | lmolCH3OH | 2molCH3OH | |
平衡 时的 数据 | CH3OH/mol·L-1 | c1 | c2 | c3 |
反应的能量变化 | 放出akJ | 吸收bkJ | 吸收ckJ | |
体系压强/Pa | p1 | p2 | p3 | |
反应物转化率 | a1 | a2 | a3 | |
下列说法中正确的是______
A.2c1>c3 B. a+b=92.9 C.2p23 D.a1+a3<1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】大气污染的危害是多方面的,它既危害人体健康,又影响动植物的生长,严重时会影响地球的气候。大气污染主要是由人为排放的烟尘和有害气体造成的。
(1)工业接触法制硫酸的主要反应之一是2SO2(g)+O2(g)![]() 2SO3(g) △H=-196.6kJ/mol
2SO3(g) △H=-196.6kJ/mol
①一定条件下,将SO2于空气充分混合并反应。t min后,SO2和SO3物质的量浓度分别为amol/L和bmol/L,则以SO2表示的化学反应速率为________________
②为了提高反应速率,同时提高SO2的转化率,从而减少SO2的排放,下列条件可改变的是_______
A 增大压强 b升高温度 c增大催化剂用量d降低温度
(2)CO2的过度排放会造成另一种大气污染——“温室效应”。CO2是目前大气中含量最高的一种温室气体。因此,控制和治理CO2是解决“温室效应”的有效途径
①下列措施中,有利于降低大气中CO2浓度的有_____________
a.采用节能技术,减少化石燃料的用量
b.鼓励乘坐公交车出行,倡导低碳生活
c.利用太阳能、风能等新型能源替代化石燃料
②另一种途径是将CO2转化成有机物实现碳循环。如:
2CO2(g)+2H2O(l) = C2H4(g)+3O2(g) △H=+1411.0kJ/mol
2CO2(g)+3H2O(l) = C2H5OH(l)+3O2(g) △H=+1366.8 kJ/mol
则由乙烯水化制乙醇的热化学方程式是:____________________________________________。
③在一定条件下:6H2(g)+2CO2(g)![]() CH3CH2OH(g)+3H2O(g)。
CH3CH2OH(g)+3H2O(g)。

根据上表中数据分析:
i.温度一定时,提高碳氢比[n(H2)/n(CO2)],CO2的转化率________(填“增大”“减小”或“不变”)
ii.该反应的正反应为_______(填“吸”或“放”)热反应
iii.为了避免乙醇燃烧释放CO2,可以设计成乙醇燃料电池,右图为该电池的结构示意图(电解质溶液为KOH溶液)。则a处电极上的电极反应式为______________________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分类法是学习和研究化学物质的一种常用科学方法.下列“链状连环”图案中,相连的两种物质均可归属为一类,相交部分A、B、C、D为其分类依据代号.请回答: ![]()
(1)请将A、B、C、D填入相应的横线内.
①两种物质都是氧化物
②两种物质都是盐
③两种物质都不是电解质
(2)用洁净的烧杯取25mL蒸馏水,加热至沸腾,逐滴加入上图中一种物质的饱和溶液5~6滴,继续加热,制得红褐色的胶体.
①以上反应的化学方程式为 .
②简述胶体制取成功的判断依据是 .
③向该胶体中逐滴加入稀硫酸,观察到:
A.先出现红褐色沉淀,说明胶体发生 .
B.随后红褐色沉淀溶解,反应的离子方程式是 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com