
【题目】W、X、Y、Z四种短周期元素在周期表中的相对位置如图所示。W、X、Y、Z原子的最外层电子数之和为21。下列说法中错误的是
![]()
A. 元素X的单质能与强酸、强碱反应
B. W的氢化物水溶液可以用于刻蚀玻璃
C. 气态氢化物的稳定性:W>Y
D. 简单阴离子的还原性:W>Z
【答案】D
【解析】
W、X、Y、Z均为短周期元素,假设W是第一周期,则W为He元素,最外层为2,那么Z、Y、X的最外层电子数分别为7、6、4,此时四种元素最外层电子数之和为19,不符合题意,故假设不成立。W应处于第二周期,X、Y、Z处于第三周期,设X的原子最外层电子数是a,则Y的最外层电子数是a+2,Z最外层电子数是a+3,W的最外层电子数是a+4,这四种元素原子的最外层电子数之和为21,则a+(a+2)+(a+3)+(a+4)=21,解得a=3,故X是Al元素、Y是P元素、Z是S元素、W为F元素。
根据上述分析知:X是Al元素、Y是P元素、Z是S元素、W为F元素;A. X是Al,既能与强酸又能与强碱反应,故A正确;B.W为F元素,氢化物为HF,其水溶液为氢氟酸,可以和玻璃的主要成分SiO2反应,HF用于刻蚀玻璃,故B正确;C. W为F元素,Y是P元素,非金属性F>P,故气态氢化物的稳定性:HF>PH3,故C正确;D、W为F元素,Z是S元素,非金属性F>S,简单阴离子的还原性为:F-<S2-,故D错误。答案:D。


科目:高中化学 来源: 题型:
【题目】下列解释事实的离子方程式正确的是
A. 明矾做净水剂:Al3++ 3H2O = Al (OH)3↓+ 3H+
B. 小苏打治疗胃酸过多:CO32-+ 2H+= CO2↑+ H2O
C. 漂白液加白醋,提高漂白效率:CH3COOH + ClO-=HClO + CH3COO-
D. 酸化的淀粉碘化钾溶液在空气中放置一段时间变蓝:4I-+ O2+2H2O= 2I2+ 4OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下向100mLFeCl3溶液中通入0.224L H2S,生成单质硫,再加入过量铁粉,反应停止后溶液中含有0.06mol阳离子。原FeCl3溶液的物质的量浓度是
A. 0.2 mol/L B. 0.3 mol/L C. 0.4 mol/L D. 0.6 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ni为第Ⅷ 族元素,在许多工业生产中都有涉及。
已知草酸镍晶体(NiC2O4·2H2O)难溶于水,工业上从废镍催化剂(成分主要为Ni,含有一定量的Al2O3、Fe、SiO2、CaO等)制备草酸镍晶体的流程如图所示:

已知:①相关金属离子生成氢氧化物沉淀的pH如下表:
金属离子 | Fe3+ | Fe2+ | Al3+ | Ni2+ |
开始沉淀的pH | 1.1 | 5.8 | 3.0 | 6.8 |
完全沉淀的pH | 3.2 | 8.8 | 5.0 | 9.5 |
②Ksp(CaF2)=1.46×10-10 ③当某物质浓度小于1.0×10-5 mol/L时,视为完全沉淀
(1)请写出一种能提高酸浸速率的措施________________。
(2)试剂a是一种绿色氧化剂,写出“氧化”时反应的离子方程式__________________________。
(3)pH的调控范围为 __________________,滤渣Ⅱ的成分为_____________________________。
(4)写出“沉镍”时反应的离子方程式___________________________________________,证明Ni2+已经沉淀完全的实验步骤及现象是______________________________________,当Ca2+沉淀完全时,溶液中c(F-)>_____________ mol/L(写出计算式即可)。
(5)操作a的内容是____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是部分短周期元素化合价与原子序数的关系图,下列说法不正确的是

A. 气态氢化物的稳定性:R>W
B. X与Y可以形成原子个数比为1:1和1:2的两种离子化合物
C. 由X、Y、Z、W、R五种元素形成的简单离子中半径最小的是X2-
D. Y和Z两者最高价氧化物对应的水化物能相互反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.需要加热方能发生的反应一定是吸热反应
B.放热反应在常温下一定很容易发生
C.反应是放热还是吸热,必须看反应物和生成物所具有的总能量的相对大小
D.化学反应只生成新物质,没有能量的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学利用下列装置探究Na与CO2反应的还原产物,已知PdCl2+CO+H2O==Pd(黑色)↓+CO2+2HCl。下列相关分析错误的是
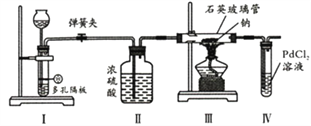
A. I中发生反应可以是Na2CO3+H2SO4==Na2SO4+H2O+CO2↑
B. II中浓硫酸的目的是干燥CO2
C. 实验时,III中石英玻璃管容易受到腐蚀
D. 步骤IV的目的是证明还原产物是否有CO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA是阿伏加德罗常数的值,下列说法正确的是
A. 16.25 g FeCl3水解形成的Fe(OH)3胶体粒子数为0.1 NA
B. 92.0 g甘油(丙三醇)中含有羟基数为1.0NA
C. 22.4 L(标准状况)氩气含有的质子数为18NA
D. 1.0 mol CH4与Cl2在光照下反应生成的CH3Cl分子数为1.0NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某反应体系中的物质有:NaOH、Au2O3、Na2S4O6、Na2S2O3、Au2O、H2O。
(1)请将Au2O3之外的反应物与生成物分别填入以下空格内:________
![]()
![]()
(2)反应中,被还原的元素是______________,还原剂是___________。
(3)请将反应物的化学式配平后的系数填入下列相应的位置中,并标出电子转移的方向和数目。________
![]()
(4)纺织工业中常用氯气作漂白剂,Na2S2O3可作为漂白布匹后的“脱氯剂”,Na2S2O3和Cl2反应的产物是H2SO4、NaCl和HCl,则还原剂与氧化剂的物质的量之比为______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com