
【题目】Ni为第Ⅷ 族元素,在许多工业生产中都有涉及。
已知草酸镍晶体(NiC2O4·2H2O)难溶于水,工业上从废镍催化剂(成分主要为Ni,含有一定量的Al2O3、Fe、SiO2、CaO等)制备草酸镍晶体的流程如图所示:

已知:①相关金属离子生成氢氧化物沉淀的pH如下表:
金属离子 | Fe3+ | Fe2+ | Al3+ | Ni2+ |
开始沉淀的pH | 1.1 | 5.8 | 3.0 | 6.8 |
完全沉淀的pH | 3.2 | 8.8 | 5.0 | 9.5 |
②Ksp(CaF2)=1.46×10-10 ③当某物质浓度小于1.0×10-5 mol/L时,视为完全沉淀
(1)请写出一种能提高酸浸速率的措施________________。
(2)试剂a是一种绿色氧化剂,写出“氧化”时反应的离子方程式__________________________。
(3)pH的调控范围为 __________________,滤渣Ⅱ的成分为_____________________________。
(4)写出“沉镍”时反应的离子方程式___________________________________________,证明Ni2+已经沉淀完全的实验步骤及现象是______________________________________,当Ca2+沉淀完全时,溶液中c(F-)>_____________ mol/L(写出计算式即可)。
(5)操作a的内容是____________________________________________。
【答案】把废镍催化剂粉碎,或适当加热,适当增大酸的浓度或搅拌2Fe2++2H+ +H2O2=2Fe3++2H2O5.0≤pH<6.8Fe(OH)3和Al(OH)3Ni2++C2O42-+2H2O=NiC2O4·2H2O取适量上层清液放入试管中,继续滴加(NH4)2C2O4溶液,无沉淀生成![]() 过滤、洗涤、干燥
过滤、洗涤、干燥
【解析】
废镍催化剂(成分主要为Ni,含有一定量的Al2O3、Fe、SiO2、CaO等),用硫酸溶解,SiO2不与硫酸反应,过滤得到滤液中含有NiSO4、FeSO4、Al2(SO4)3、CaSO4及过量的硫酸,试剂a是一种绿色氧化剂,所以加入 的是加入H2O2将Fe2+氧化为Fe3+,加入Ni(OH)2调节pH,使pH大于5.0小于6.8,Fe3+转化为Fe(OH)3沉淀、Al3+转化为Al(OH)3沉淀,过滤除去,滤液中含有NiSO4、CaSO4,向滤液中加入NH4F,除去Ca2+,过滤,再向滤液中加入(NH4)2C2O4,得到草酸镍沉淀,再过滤、洗涤、干燥得草酸镍晶体,据此分析。
废镍催化剂(成分主要为Ni,含有一定量的Al2O3、Fe、SiO2、CaO等),用硫酸溶解,SiO2不与硫酸反应,过滤得到滤液中含有NiSO4、FeSO4、Al2(SO4)3、CaSO4及过量的硫酸,试剂a是一种绿色氧化剂,所以加入 的是加入H2O2将Fe2+氧化为Fe3+,加入Ni(OH)2调节pH,使pH大于5.0小于6.8,Fe3+转化为Fe(OH)3沉淀、Al3+转化为Al(OH)3沉淀,过滤除去,滤液中含有NiSO4、CaSO4,向滤液中加入NH4F,除去Ca2+,过滤,再向滤液中加入(NH4)2C2O4,得到草酸镍沉淀,再过滤、洗涤、干燥得草酸镍晶体,(1)根据影响化学反应速率的因素可知,提高浸出率,可把废镍催化剂粉碎或适当加热、适当增大硫酸浓度、搅拌等;
(2)根据上面的分析可知,试剂a是H2O2,所以“氧化”时反应的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O;
(3)根据表中的数据可知,pH为5.0时,Fe3+、Al3+沉淀完全,pH为6.8时Ni2+开始沉淀,所以pH的调控范围为5.0≤pH<6.8,其反应的原理为:加入Ni(OH)2调节消耗溶液中的氢离子,促使Fe3+、Al3+的水解平衡右移,使Fe3+、Al3+转化为相应的沉淀,滤渣Ⅱ的成分为Fe(OH)3和Al(OH)3;
(4)“沉镍”时反应的离子方程式为Ni2++C2O42-+2H2O=NiC2O42H2O,证明Ni2+已经沉淀完全的实验步骤及现象是取上层清液,继续滴加(NH4)2C2O4溶液,无沉淀生成;当Ca2+沉淀完全时,即c(Ca2+)<10-5mol/L,根据Ksp(CaF2)=1.46×10-10,可知溶液中c2(F-)>![]() mol/L,c(F-)>
mol/L,c(F-)>![]() ;
;
(5)根据上面的分析可知,操作a的内容是过滤、洗涤、干燥。


科目:高中化学 来源: 题型:
【题目】下表是元素周期表中的一部分元素,用元素符号或化学式回答下列问题:
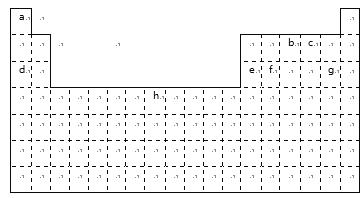
(1)h元素在周期表中的位置是_______;
(2)表中所列元素中,金属性最强的是____;元素最高价含氧酸酸性最强的是____;(填化学式)
(3)c、d、e、g中,离子半径最小的是____;(填离子符号)
(4)a和b化合时形成_____键;a和d化合时形成______键;
(5)由a、c、d形成的化合物的电子式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知甲、乙、丙、 X 是4种中学化学中常见的物质,其转化关系符合下图(部分产物已略去)。下列说法中,正确的是
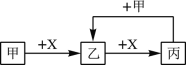
A. 若甲为单质铁,则丙一定为FeCl3
B. 若甲为强碱,则X一定为CO2
C. 若乙是一种白色胶状沉淀,则甲溶液中一定含有Al3+
D. 若甲为单质,则此关系中涉及的反应一定都是氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家最近研制出可望成为高效火箭推进剂的 N(NO2)3,如图。已知该分子中N-N-N 键角都是108.1°,下列有关 N(NO2)3 的说法不正确的是( )

A. 该分子中既含有非极性键又含有极性键
B. 分子中四个氮原子不共平面
C. 该物质既有氧化性又有还原性
D. 15.2g 该物质含有6.02×1022个原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E都是短周期主族元素,原子序数依次增大,B、C同周期,A、D同主族。A、B能形成两种液态化合物甲和乙,原子个数比分别为2∶1和1∶1,E元素形成的简单离子是同周期元素中离子半径最小的。根据以上信息回答下列问题:
(1)甲、乙两分子中含有非极性共价键的物质的电子式是__________________,C元素在周期表中的位置是_________________________;
(2)C和D的离子中,半径较小的是_____________;(填离子符号)。
(3)将D的单质投入甲中,待D消失后再向上述溶液中加入E的单质,此时发生反应的离子方程式是______________________________________________________;
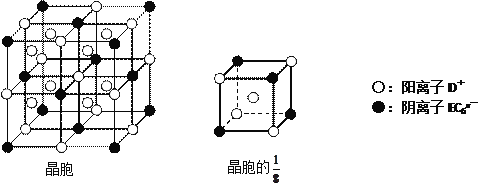
(4)C、D、E可组成离子化合物DxEC6,其晶胞(晶胞是在晶体中具有代表性的最小重复单元)结构如下图所示,阳离子D+(用○表示)位于正方体的棱的中点和正方体内部;阴离子EC6x-(用●表示)位于该正方体的顶点和面心。该化合物的化学式是___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】全世界每年被腐蚀损耗的钢铁量非常惊人,在潮湿空气中发生吸氧腐蚀是钢铁腐蚀的主要原因。
(1)在潮湿空气中,钢铁发生吸氧腐蚀时的正极反应式为________________________。
(2)已知草酸分解的化学方程式为:H2C2O4![]() CO↑ + CO2↑ + H2O,下列装置中,可用作草酸分解制取气体的是________________。
CO↑ + CO2↑ + H2O,下列装置中,可用作草酸分解制取气体的是________________。
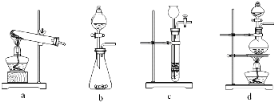
(3)某实验小组利用草酸分解产生的CO和铁锈反应来测定铁锈样品的组成(假定铁锈中只有Fe2O3· nH2O和Fe两种成份),实验装置如下图所示。

①为得到干燥、纯净的CO气体,洗气瓶A、B中盛放的液态试剂依次可能是_______、________(填答案编号)。
a. 浓硫酸 b.澄清的石灰水 c. 氢氧化钠溶液 d. 无水氯化钙
②在点燃C处酒精灯之前应进行的操作是:(a)检查装置气密性;(b)____________。
③E装置的作用是___________________________________________________________ 。
④准确称量样品10.00g置于硬质玻璃管中,充分反应后冷却、称量(假设每步均完全反应),硬质玻璃管中剩余固体质量为8.32 g,D中浓硫酸增重0.72 g,则n =_____________。
⑤在本实验中,下列情况会使测定结果n偏大的是__________(填答案编号)。
a.缺少装置B b.缺少装置E c.反应后的固体中有少量Fe2O3·nH2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z四种短周期元素在周期表中的相对位置如图所示。W、X、Y、Z原子的最外层电子数之和为21。下列说法中错误的是
![]()
A. 元素X的单质能与强酸、强碱反应
B. W的氢化物水溶液可以用于刻蚀玻璃
C. 气态氢化物的稳定性:W>Y
D. 简单阴离子的还原性:W>Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某稀溶液中含有4 mol KNO3和2.5 mol H2SO4,向其中加入1.5 mol Fe,充分反应(已知NO![]() 被还原为NO),最终溶液体积为1L。下列说法正确的是( )
被还原为NO),最终溶液体积为1L。下列说法正确的是( )
A. 反应后生成NO的体积为33.6 L (标况)
B. 所得溶液中c(Fe2+)∶c(Fe3+)=1∶2
C. 所得溶液中c(NO![]() )=2.75 mol·L-1
)=2.75 mol·L-1
D. 所得溶液中的溶质只有FeSO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列解释事实的化学方程式不正确的是
A. 盛放烧碱溶液的试剂瓶不能用玻璃塞:SiO2 + 2NaOH ![]() Na2SiO3 + H2O
Na2SiO3 + H2O
B. 氢氧化铜溶于过量氨水:Cu(OH)2 + 4NH3 ![]() [Cu(NH3)4](OH)2
[Cu(NH3)4](OH)2
C. 铁在潮湿的环境中生锈:3Fe + 4H2O(g) ![]() Fe3O4 + 4H2
Fe3O4 + 4H2
D. 向煤中加入石灰石可减少煤燃烧时SO2的排放:2CaCO3+O2+2SO2![]() 2CaSO4+2CO2
2CaSO4+2CO2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com