
【题目】A、B、C、D、E都是短周期主族元素,原子序数依次增大,B、C同周期,A、D同主族。A、B能形成两种液态化合物甲和乙,原子个数比分别为2∶1和1∶1,E元素形成的简单离子是同周期元素中离子半径最小的。根据以上信息回答下列问题:
(1)甲、乙两分子中含有非极性共价键的物质的电子式是__________________,C元素在周期表中的位置是_________________________;
(2)C和D的离子中,半径较小的是_____________;(填离子符号)。
(3)将D的单质投入甲中,待D消失后再向上述溶液中加入E的单质,此时发生反应的离子方程式是______________________________________________________;
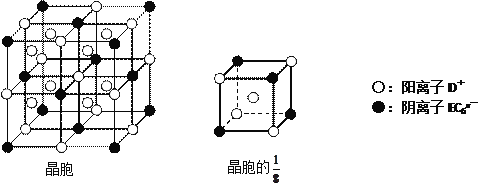
(4)C、D、E可组成离子化合物DxEC6,其晶胞(晶胞是在晶体中具有代表性的最小重复单元)结构如下图所示,阳离子D+(用○表示)位于正方体的棱的中点和正方体内部;阴离子EC6x-(用●表示)位于该正方体的顶点和面心。该化合物的化学式是___________________。
【答案】 ![]() 第二周期、第ⅦA族 Na+ 2Al+2OH-+2H2O=2AlO2-+3H2↑ Na3AlF6
第二周期、第ⅦA族 Na+ 2Al+2OH-+2H2O=2AlO2-+3H2↑ Na3AlF6
【解析】本题考查的是位置、结构和性质的关系以及应用,明确元素的推断是解答的关键,熟悉元素周期表和元素周期律即可解答。
A、B、C、D、E都是短周期主族元素,原子序数依次增大。A、B能形成两种液态化合物甲和乙,原子个数比分别为2∶1和1∶1,说明A为氢元素,B为氧元素,二者形成水和双氧水两种物质,B、C同周期,则C为氟元素,A、D同主族,则D为钠元素,E元素形成的简单离子是同周期元素中离子半径最小的,为铝元素。(1)根据以上分析,甲为水,乙为双氧水,两分子中含有非极性共价键的物质即双氧水,电子式是![]() ,C为氟元素,在周期表中的位置是第二周期、第ⅦA族。(2)氟离子和钠离子是电子层结构相同的离子,根据序小径大分析,半径较小的是Na+。(3)将钠的单质投入水中,反应生成氢氧化钠和氢气,待钠消失后再向氢氧化钠溶液中加入铝的单质,此时铝和氢氧化钠反应生成偏铝酸钠和氢气,反应的离子方程式是2Al+2OH-+2H2O=2AlO2-+3H2↑。(4)该晶胞的1/8中含有的钠离子个数为
,C为氟元素,在周期表中的位置是第二周期、第ⅦA族。(2)氟离子和钠离子是电子层结构相同的离子,根据序小径大分析,半径较小的是Na+。(3)将钠的单质投入水中,反应生成氢氧化钠和氢气,待钠消失后再向氢氧化钠溶液中加入铝的单质,此时铝和氢氧化钠反应生成偏铝酸钠和氢气,反应的离子方程式是2Al+2OH-+2H2O=2AlO2-+3H2↑。(4)该晶胞的1/8中含有的钠离子个数为![]() ,阴离子个数
,阴离子个数![]() ,所以其化学式中阴阳离子个数之比为1:3,化学式为Na3AlF6。
,所以其化学式中阴阳离子个数之比为1:3,化学式为Na3AlF6。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
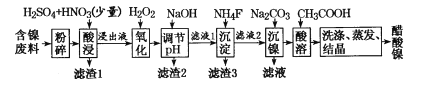
【题目】醋酸镍((CH3COO)2Ni]是一种重要的化工原料。一种以含镍废料(含NiS、Al2O3、FeO、CaO、SiO2)为原料,制取醋酸镍的工艺流程图如下:
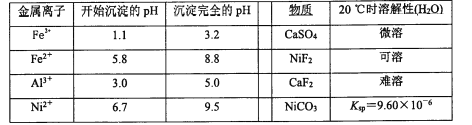
相关离子生成氢氧化物的pH和相关物质的溶解性如下表:
(1)粉碎含镍废料的作用__________________________________
(2)酸浸过程中,l molNiS失去6NA个电子,同时生成两种无色有毒气体。写出该反应的化学方程式:___。
(3)写出氧化步骤中加入H2O2发生反应的离子方程式:____。
(4)调节pH除铁、铝步骤中,溶液pH的调节范围是____。
(5)滤渣3主要成分的化学式是____。
(6)沉镍过程中,若c(Ni2+)= 2.0 mol.L-1,欲使100 mL该滤液中的Ni2+沉淀完全[c(Ni2+)≤10-5 mol·L-1],则需要加入Na2CO3固体的质量最少为____g(保留一位小数)。
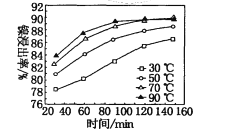
(7)保持其他条件不变,在不同温度下对含镍废料进行酸浸,镍浸出率随时间变化如图。酸浸的最佳温度与时间分别为____℃、______min。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知 As元素的部分信息如图所示,下列说法不正确的是

A. H3AsO4和H3PO4都能与NaOH溶液反应生成相应的盐
B. 热稳定性:AsH3、H2S、HCl逐渐增强
C. As的一种核素表示为![]() ,中子数为40
,中子数为40
D. 原子半径由大到小的顺序:As、Cl、Si
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下向100mLFeCl3溶液中通入0.224L H2S,生成单质硫,再加入过量铁粉,反应停止后溶液中含有0.06mol阳离子。原FeCl3溶液的物质的量浓度是
A. 0.2 mol/L B. 0.3 mol/L C. 0.4 mol/L D. 0.6 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ni为第Ⅷ 族元素,在许多工业生产中都有涉及。
已知草酸镍晶体(NiC2O4·2H2O)难溶于水,工业上从废镍催化剂(成分主要为Ni,含有一定量的Al2O3、Fe、SiO2、CaO等)制备草酸镍晶体的流程如图所示:

已知:①相关金属离子生成氢氧化物沉淀的pH如下表:
金属离子 | Fe3+ | Fe2+ | Al3+ | Ni2+ |
开始沉淀的pH | 1.1 | 5.8 | 3.0 | 6.8 |
完全沉淀的pH | 3.2 | 8.8 | 5.0 | 9.5 |
②Ksp(CaF2)=1.46×10-10 ③当某物质浓度小于1.0×10-5 mol/L时,视为完全沉淀
(1)请写出一种能提高酸浸速率的措施________________。
(2)试剂a是一种绿色氧化剂,写出“氧化”时反应的离子方程式__________________________。
(3)pH的调控范围为 __________________,滤渣Ⅱ的成分为_____________________________。
(4)写出“沉镍”时反应的离子方程式___________________________________________,证明Ni2+已经沉淀完全的实验步骤及现象是______________________________________,当Ca2+沉淀完全时,溶液中c(F-)>_____________ mol/L(写出计算式即可)。
(5)操作a的内容是____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是部分短周期元素化合价与原子序数的关系图,下列说法不正确的是

A. 气态氢化物的稳定性:R>W
B. X与Y可以形成原子个数比为1:1和1:2的两种离子化合物
C. 由X、Y、Z、W、R五种元素形成的简单离子中半径最小的是X2-
D. Y和Z两者最高价氧化物对应的水化物能相互反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学利用下列装置探究Na与CO2反应的还原产物,已知PdCl2+CO+H2O==Pd(黑色)↓+CO2+2HCl。下列相关分析错误的是
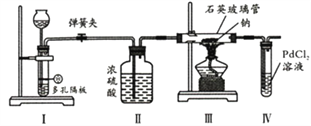
A. I中发生反应可以是Na2CO3+H2SO4==Na2SO4+H2O+CO2↑
B. II中浓硫酸的目的是干燥CO2
C. 实验时,III中石英玻璃管容易受到腐蚀
D. 步骤IV的目的是证明还原产物是否有CO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】测定气体摩尔体积的实验中,以下情况不影响测定结果的是( )
A.镁条表面的氧化膜未完全擦去B.镁带中含有不与酸反应的杂质
C.反应后没有用注射器抽气D.硫酸过量,镁全部反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com