
| A. | 氯化氢能使湿润的蓝色石蕊试纸变为红色,是因为HCl分子中含有H+ | |
| B. | 氯化氢极易溶于水,常温常压下1体积水可溶解500体积HCl | |
| C. | 氯化氢可以用向上排空气法收集 | |
| D. | 氯化氢和盐酸的化学式都是HCl |
科目:高中化学 来源: 题型:选择题
| A. | 溶液质量减轻 | |
| B. | Fe3+的氧化性大于Cu2+ | |
| C. | 溶液中Cu2+与Fe2+的物质的量比为1:1 | |
| D. | 1 mol Fe可还原2 mol Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 甲 | 乙 | 丙 |
| 柚子 | 黄瓜 | 脐橙 |
| HOCH2COOH | C3H4O5 | 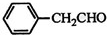 |
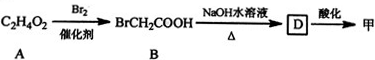
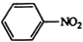 $\stackrel{Fe,HCl}{→}$
$\stackrel{Fe,HCl}{→}$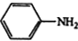 $→_{(2)H_{2}O,H+,△}^{(1)NaNO_{2},HCl}$
$→_{(2)H_{2}O,H+,△}^{(1)NaNO_{2},HCl}$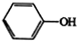
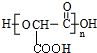 +(n-1)H2O.
+(n-1)H2O.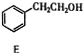 $\stackrel{经两步}{→}$
$\stackrel{经两步}{→}$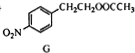 $→_{(2)H+,△}^{(1)Fe,HCl}$$\stackrel{{C}_{8}{H}_{11}NO}{H}$$→_{(2)H_{2}O,H+,△}^{(1)NaNO_{2},HCl}$J
$→_{(2)H+,△}^{(1)Fe,HCl}$$\stackrel{{C}_{8}{H}_{11}NO}{H}$$→_{(2)H_{2}O,H+,△}^{(1)NaNO_{2},HCl}$J查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
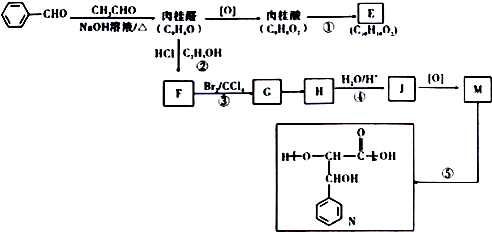
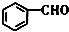 的名称是苯甲醛.
的名称是苯甲醛.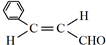 ,分子中最多有18个原子共平面.
,分子中最多有18个原子共平面. .
.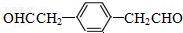 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 此烃名称为4-甲基-1-戊炔.
此烃名称为4-甲基-1-戊炔. 的烃可命名为1-甲基-3-乙基苯.
的烃可命名为1-甲基-3-乙基苯. 的烃可命名为:2,4-二甲基-3-乙基戊烷.
的烃可命名为:2,4-二甲基-3-乙基戊烷. 的键线式:
的键线式: .
. 的键线式:
的键线式: .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
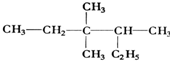 3,3,4-三甲基己烷
3,3,4-三甲基己烷 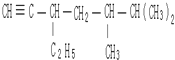 5,6-二甲基-3-乙基-1-庚炔
5,6-二甲基-3-乙基-1-庚炔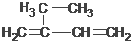 2-乙基-1,3-丁二烯
2-乙基-1,3-丁二烯 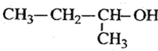 2-丁醇
2-丁醇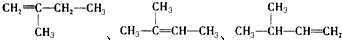 .
.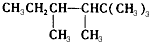 ,若A是单烯烃与氢气加成后的产物.则该单烯烃可能有5种结构.
,若A是单烯烃与氢气加成后的产物.则该单烯烃可能有5种结构.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA |
| 1 | ① | ||||||
| 2 | ② | ③ | ④ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C(s)+$\frac{1}{2}$O2(g)═CO(g)△H=+110.5 kJ•mol-1 | |
| B. | C(s)+O2(g)═CO2(g)△H=-393.5 kJ•mol-1 | |
| C. | 2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ•mol-1 | |
| D. | H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-241.8 kJ•mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com