
【题目】锂-空气电池的装置示意图如下,以金属锂作电极,从空气中获得O2。下列说法正确的是( )
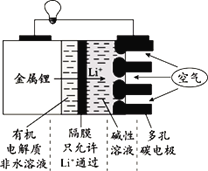
A.锂作负极,电极反应式为:Li-e-+OH-=LiOH
B.若隔膜被腐蚀,不会影响该电池正常使用
C.多孔碳电极上发生的电极反应为:O2+2H2O+4e-=4OH-
D.应用该电池电镀铜,若析出64g Cu,理论上消耗22.4L O2
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】用如图装置研究电化学原理,下列分析中错误的是
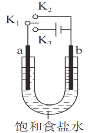
选项 | 连接 | 电极材料 | 分析 | |
a | b | |||
A | K1K2 | 石墨 | 铁 | 模拟铁的吸氧腐蚀 |
B | K1K2 | 锌 | 铁 | 模拟钢铁防护中牺牲阳极的阴极保护法 |
C | K1K3 | 石墨 | 铁 | 模拟电解饱和食盐水 |
D | K1K3 | 铁 | 石墨 | 模拟钢铁防护中外加电流的阴极保护法 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃煤废气中的氮氧化物(NOx)、CO2、SO2等气体,常要采用不同方法处理,以实现节能减排、废物利用等。
(1)下列为二氧化硫和氮的氧化物转化的部分环节:
①已知:2SO2(g)+O2(g) 2SO3(g)△H=-196.6 kJmol-1
2NO(g)+O2(g) 2NO2(g)△H=-113.0 kJ·mol-1
则 SO2 气体与 NO2 气体反应生成 SO3 气体和 NO 气体的热化学方程式为 _______________。
②一定条件下,工业上可通过下列反应实现燃煤烟气中液态硫的回收,其中Y是单质: SO2(g)+2CO(g)![]() 2X(g)+Y(l)。为了测定在某种催化剂作用下的反应速率,某化学兴趣小组在某温度下、固定容器中用超灵敏气体传感器测得不同时间的 SO2 和 CO 浓度如下表:
2X(g)+Y(l)。为了测定在某种催化剂作用下的反应速率,某化学兴趣小组在某温度下、固定容器中用超灵敏气体传感器测得不同时间的 SO2 和 CO 浓度如下表:
时间/s | 0 | 1 | 2 | 3 | 4 |
c(SO2)/mol·L-1 | 1.00 | 0.50 | 0.23 | 3.00×10-37 | 3.00×10-37 |
c(CO)/mol·L-1 | 4.00 | 3.00 | 2.46 | 2.00 | 2.00 |
X的化学式为______;当时间为第4s时,v(SO2)正_____(填“>”“=”或“<”)v(X)逆。
(2)有科学家经过研究发现,在210~290℃、催化剂条件下用H2可将CO2转化生成甲醇蒸气和水蒸气。一定条件下,往2 L恒容密闭容器中充入 1 mol CO2 和 3.0 mol H2,在不同催化 剂作用下,相同时间内 CO2 的转化率随温度变化如图所示:
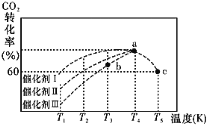
①催化剂效果最佳的是催化剂 _______(填“I”“II”或“III”)。
②此反应中a点的转化率比b点高的原因是__________________ 。 已知容器内的起始压强为100 kPa,则图中c点对应温度下反应的平衡常数 Kp=_____(保 留两位有效数字)(Kp为以分压表示的平衡常数,分压=总压×物质的量分数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒容密闭容器中发生2NO2![]() 2NO+O2,下列说法能够判断该反应达到化学平衡状态的个数是
2NO+O2,下列说法能够判断该反应达到化学平衡状态的个数是
①单位时间内生成nmolO2的同时生成2nmolNO
②单位时间内NO2、NO、O2的物质的量浓度变化量之比为2︰1︰1
③混合气体的颜色不再改变 ④混合气体的密度不再改变
⑤混合气体的平均相对分子质量不再改变 ⑥混合体系中c(NO)保持不变
A.1个B.2个C.3个D.4个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃,下列有关电解质溶液的说法正确的是
A.向NaF溶液中滴加硫酸至中性时,c(Na+)=2c(SO![]() )+c(F-)
)+c(F-)
B.稀醋酸中加入冰醋酸,醋酸电离平衡右移,电离度增大
C.向氨水中加入NH4Cl固体,溶液中 ![]() 增大
增大
D.将NaClO溶液从20 ℃升温至30 ℃,溶液中![]() 增大
增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸乙酯广泛用于药物、染料、香料等工业,某学习小组设计以下两套装置用乙醇、乙酸和浓硫酸分别制备乙酸乙酯(沸点77.2℃)。下列说法不正确的是
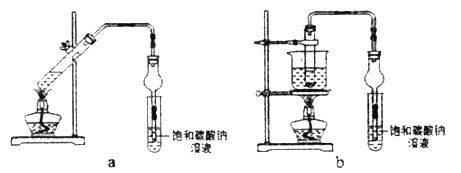
A. 浓硫酸能加快酯化反应速率 B. 不断蒸出酯,会降低其产率
C. 装置b比装置a原料损失的少 D. 可用分液的方法分离出乙酸乙酯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴乙烷是有机合成中的重要原料。实验室制备溴乙烷(C2H5Br,沸点38.4℃)的装置如图所示,其实验步骤为:①检查装置的气密性,向装置图所示的U形管和大烧杯中加入冰水;②向仪器a中加入10mL 95%乙醇、28mL 92%浓硫酸,然后加入适量溴化钠和几粒碎瓷片;③在45~50℃加热2h,使其充分反应。回答下列问题:
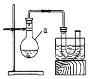
(1)仪器a的名称是________。
(2)在大烧杯中加入冰水的目的是________。
(3)加入碎瓷片的作用是________。
(4)为了更好的控制温度,选择常用的加热方式为________。
(5)反应时若温度过高,可看到有红棕色气体产生,该气体分子式为________,生成的无色刺激性气味气体的分子式为________。
(6)U形管内可观察到的现象是_____________。
(7)反应结束后,U形管内粗制的C2H5Br呈棕黄色。为了除去粗产品中的杂质,可以选择下列试剂中的________(填序号)。
A.Na2SO3溶液 B.H2O C.NaOH溶液 D.苯
(8)检验溴乙烷中溴元素的实验步骤是:取少量溴乙烷于试管中,加入NaOH溶液,加热煮沸一段时间,冷却,________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,0.2mol/L的一元碱BOH与等浓度的HCl溶液等体积混合后,所得溶液中部分微粒组分及浓度如图所示,下列说法正确的是( )
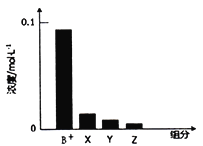
A. BOH为强碱 B. 该混合液pH=7
C. 图中X表示BOH,Y表示H+,Z表示OH- D. 该混合溶液中:c(Cl-)=c(Y)+c(B+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物M的一种合成路线如图所示:
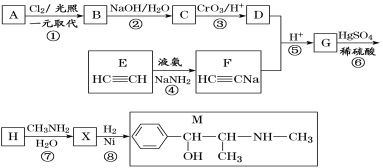
已知:(1)R—CH2OH![]() RCHO
RCHO
(2)R1-CHO+R-C≡CNa![]()
![]()
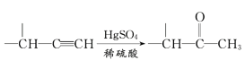
(3)
(4)![]()
请回答下列问题:
(1)D的名称是_______;G中含氧官能团的名称是_______。
(2)反应②的反应类型为_______;A的结构简式为_______。
(3)写出反应⑦的化学方程式:______________________________。
(4)在H的同分异构体中,写出符合下列要求的同分异构体有_______种
a. 属于芳香族化合物
b. 能发生水解反应和银镜反应,且水解产物之一遇FeCl3溶液呈紫色
其中的核磁共振氢谱上有4组峰,且峰面积之比为1∶1∶2∶6的有机物的结构简式(任写一种)_________________。
(6)已知:![]() 仿照上述流程,设计以苯、乙醛为主要原料合成某药物中间体
仿照上述流程,设计以苯、乙醛为主要原料合成某药物中间体![]() 的路线________________。
的路线________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com