
【题目】燃煤废气中的氮氧化物(NOx)、CO2、SO2等气体,常要采用不同方法处理,以实现节能减排、废物利用等。
(1)下列为二氧化硫和氮的氧化物转化的部分环节:
①已知:2SO2(g)+O2(g) 2SO3(g)△H=-196.6 kJmol-1
2NO(g)+O2(g) 2NO2(g)△H=-113.0 kJ·mol-1
则 SO2 气体与 NO2 气体反应生成 SO3 气体和 NO 气体的热化学方程式为 _______________。
②一定条件下,工业上可通过下列反应实现燃煤烟气中液态硫的回收,其中Y是单质: SO2(g)+2CO(g)![]() 2X(g)+Y(l)。为了测定在某种催化剂作用下的反应速率,某化学兴趣小组在某温度下、固定容器中用超灵敏气体传感器测得不同时间的 SO2 和 CO 浓度如下表:
2X(g)+Y(l)。为了测定在某种催化剂作用下的反应速率,某化学兴趣小组在某温度下、固定容器中用超灵敏气体传感器测得不同时间的 SO2 和 CO 浓度如下表:
时间/s | 0 | 1 | 2 | 3 | 4 |
c(SO2)/mol·L-1 | 1.00 | 0.50 | 0.23 | 3.00×10-37 | 3.00×10-37 |
c(CO)/mol·L-1 | 4.00 | 3.00 | 2.46 | 2.00 | 2.00 |
X的化学式为______;当时间为第4s时,v(SO2)正_____(填“>”“=”或“<”)v(X)逆。
(2)有科学家经过研究发现,在210~290℃、催化剂条件下用H2可将CO2转化生成甲醇蒸气和水蒸气。一定条件下,往2 L恒容密闭容器中充入 1 mol CO2 和 3.0 mol H2,在不同催化 剂作用下,相同时间内 CO2 的转化率随温度变化如图所示:
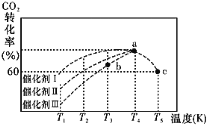
①催化剂效果最佳的是催化剂 _______(填“I”“II”或“III”)。
②此反应中a点的转化率比b点高的原因是__________________ 。 已知容器内的起始压强为100 kPa,则图中c点对应温度下反应的平衡常数 Kp=_____(保 留两位有效数字)(Kp为以分压表示的平衡常数,分压=总压×物质的量分数)。
【答案】SO2(g)+NO2(g)![]() NO(g)+SO3(g) △H=-41.8kJ·mol-1 CO2 < Ⅰ a点温度比b点高,a比b应先到达化学平衡状态,故a点已达平衡,平衡转化率高,而b点未到达平衡,转化率低 8.3×10-4(kPa)-2
NO(g)+SO3(g) △H=-41.8kJ·mol-1 CO2 < Ⅰ a点温度比b点高,a比b应先到达化学平衡状态,故a点已达平衡,平衡转化率高,而b点未到达平衡,转化率低 8.3×10-4(kPa)-2
【解析】
根据盖斯定律得到热化学方程式;根据原子守恒思想得出X的化学式;当时间为第4s时,已经达到平衡,则速率比等于计量系数比,该反应是放热反应,温度越高,平衡逆向移动,建立三段式,先计算平衡后的压强,再根据压强平衡常数计算。
(1)①第一个方程式减去第二个方程式,再除以2得到SO2气体与NO2气体反应生成SO3气体和NO气体的热化学方程式为SO2(g)+NO2(g)![]() SO3(g) +NO(g) △H=-41.8 kJ·mol-1,故答案为:SO2(g)+NO2(g)
SO3(g) +NO(g) △H=-41.8 kJ·mol-1,故答案为:SO2(g)+NO2(g)![]() SO3(g) +NO(g) △H=-41.8 kJ·mol-1;
SO3(g) +NO(g) △H=-41.8 kJ·mol-1;
②Y为S,根据原子守恒思想得出X的化学式为CO2;当时间为第4 s时,已经达到平衡,则速率比等于计量系数比,故2v(SO2)正=v(X)逆,则v(SO2)正<v(X)逆,故答案为:CO2;<;
(2)①T3温度以前,相同温度下,催化剂Ⅰ的催化效率更高;故答案为:I;
②该反应是放热反应,温度越高,平衡逆向移动,因此a点的转化率比b点高的原因是a点温度比b点高,a比b应先到达化学平衡状态,故a点已达平衡,平衡转化率高,而b点未到达平衡,转化率低,故答案为:a点温度比b点高,a比b应先到达化学平衡状态,故a点已达平衡,平衡转化率高,而b点未到达平衡,转化率低;
已知容器内的起始压强为100 kPa,c点时CO2的转化率为60%,可列三段式:
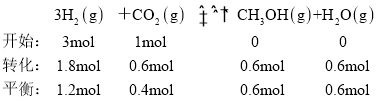
利用压强之比等于物质的量之比,![]() ,反应后的压强为
,反应后的压强为![]() ,
,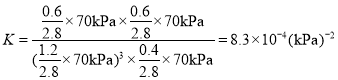 ;故答案为:a点达到平衡,c点温度升高,反应是放热反应,平衡逆向,转化率减小;
;故答案为:a点达到平衡,c点温度升高,反应是放热反应,平衡逆向,转化率减小;![]() 。
。


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:
【题目】H7N9型禽流感是全球首次发现的新亚型流感病毒,达菲(Tamiflu)是治疗该病毒的最佳药物.以莽草酸为原料,经多步反应可制得达菲和对羟基苯甲酸.达菲、莽草酸、对羟基苯甲酸的结构简式如下:
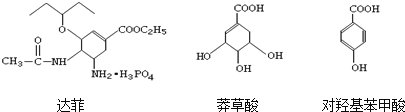
下列有关说法正确的是( )
A. 达菲、莽草酸、对羟基苯甲酸都属于芳香族化合物
B. 1mol莽草酸与NaOH溶液反应,最多消耗4mol NaOH
C. 对羟基苯甲酸较稳定,在空气中不易被氧化
D. 利用FeCl3溶液可区别莽草酸和对羟基苯甲酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】位于不同主族的四种短周期元素甲、乙、丙、丁,其原子序数依次增大,原子半径r(丁)>r(乙)>r(丙)>r(甲)。四种元素中,只有一种为金属元素,乙和丙原子的最外层电子数之和为丁原子的最外层电子数的3倍。据此推断,下述正确的是
A.简单氢化物的沸点:乙>丙
B.由甲、乙两元素组成的化合物溶于水呈碱性
C.丙和丁两元素的最高价氧化物的水化物之间能发生反应
D.由甲和丙两元素组成的分子,不可能含非极性键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列装置中有机物样品在电炉中充分燃烧,通过测定生的CO2和H2O的质量,来确定有机物分子式。
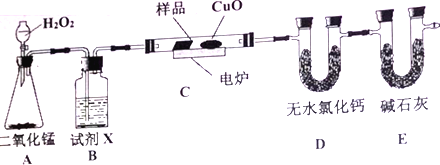
请回答下列问题:
(1)A装置是提供实验所需的O2,则A装置中二氧化锰的作用是____________________; B装置中试剂X可选用______________________。
(2)D装置中无水氯化钙的作用是____________________;E装置中碱石灰的作用是______________。
(3)若实验中所取样品只含C、H、O三种元素中的两种或三种,准确称取0.44g样品,经充分反应后,D管质量增加0.36g,E管质量增加0.88g,已知该物质的相对分子质量为44,则该样品的化学式为______________________。
(4)若该有机物的核磁共振氢谱如下图所示,峰面积之比为1:3
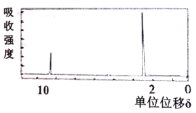
则其结构简式为____________________;若符合下列条件,则该有机物的结构简式为____________________。
①环状化合物 ②只有一种类型的氢原子
(5)某同学认为E和空气相通,会影响测定结果准确性,应在E后再增加一个E装置,其主要目的是__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】美托洛尔可用于治疗各类型高血压及心绞痛,其一种合成路线如下:

已知:①CH3COCH2R![]() CH3CH2CH2R
CH3CH2CH2R
② B- F苯环上均只有两个取代基
回答下列问题:
(1)A的化学名称是___,C中含氧官能团的名称是___
(2)E→F的反应类型是___,G的分子式为___。
(3)D的结构简式为___。
(4)反应B→C的化学方程式为___
(5)芳香族化合物W是G的同分异构体,W能发生水解反应,核磁共振氢谱有4组峰,峰面积之比为9:3:2:2,写出一种符合要求的W的结构简式:___.
(6)4一苄基苯酚(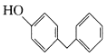 )是一种药物中间体,请设计以苯甲醇和苯酚为原料制备4-苄基苯酚的合成路线:______(无机试剂任用)。
)是一种药物中间体,请设计以苯甲醇和苯酚为原料制备4-苄基苯酚的合成路线:______(无机试剂任用)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中能大量共存的是( )
A.无色透明的溶液中:K+、Cr2O72-、Cl-、H+
B.![]() =1×1012的溶液中:K+、Na+、CO32-、NO3-
=1×1012的溶液中:K+、Na+、CO32-、NO3-
C.c(SO32-)=0.1mol·L-1的溶液中:Na+、Cl-、H+、Ca2+
D.使pH试纸变红的溶液中:NH4+、Al3+、SO42-、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.按系统命名法:CH3CH(C2H5)CH(CH3)2的正确名称:2-甲基-3-乙基丁烷
B.某有机分子结构是:![]() ,其单体可能是乙二醇和对苯二甲酸
,其单体可能是乙二醇和对苯二甲酸
C.等质量的乳酸(C3H6O3)和葡萄糖分别完全燃烧,后者消耗氧气的物质的量多
D.有机物![]() 一定条件下与H2进行1:1加成反应,产物共有3种
一定条件下与H2进行1:1加成反应,产物共有3种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂-空气电池的装置示意图如下,以金属锂作电极,从空气中获得O2。下列说法正确的是( )
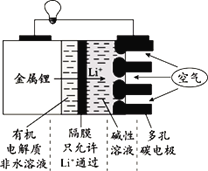
A.锂作负极,电极反应式为:Li-e-+OH-=LiOH
B.若隔膜被腐蚀,不会影响该电池正常使用
C.多孔碳电极上发生的电极反应为:O2+2H2O+4e-=4OH-
D.应用该电池电镀铜,若析出64g Cu,理论上消耗22.4L O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁及铁的氧化物广泛应于生产、生活、航天、科研领域。
(1)铁氧化合物循环分解水制H2
已知:H2O(l)===H2(g)+![]() O2(g) ΔH1=+285.5 kJ/mol
O2(g) ΔH1=+285.5 kJ/mol
6FeO(s)+O2(g) ===2Fe3O4(s) ΔH2=-313.2 kJ/mol
则:3FeO(s)+H2O(l)===H2(g)+Fe3O4(s) ΔH3=___________
(2)Fe2O3与CH4反应可制备“纳米级”金属铁,其反应为: 3CH4(g) + Fe2O3(s) ![]() 2Fe(s) +6H2(g) +3CO(g) ΔH4
2Fe(s) +6H2(g) +3CO(g) ΔH4
①此反应的化学平衡常数表达式为_________________________________。
②在容积均为VL的Ⅰ、Ⅱ、Ⅲ三个相同密闭容器中加入足量“纳米级”金属铁,然后分别充入amolCO和2a molH2,三个容器的反应温度分别保持T1、T2、T3,在其他条件相同的情况下,实验测得反应均进行到tmin时CO的体积分数如图1所示,此时I、II、III三个容器中一定处于化学平衡状态的是___________(选填“Ⅰ”“Ⅱ”或“Ⅲ”);制备“纳米级”金属铁的反应:ΔH4 _____ 0(填“>”或“<”)。
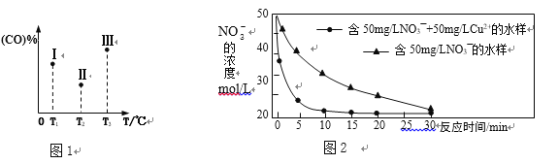
③在T℃下,向某恒容密闭容器中加入3molCH4(g)和2mol Fe2O3(s)进行上述反应,反应起始时压强为P0,反应进行至10min时达到平衡状态,测得此时容器的气体压强是起始压强的2倍。10 min内用Fe2O3(s)表示的平均反应速率为_______g·min-1; T℃下该反应的Kp = _____________________;T℃下若起始时向该容器中加入2molCH4(g)、4mol Fe2O3(s)、1molFe(s)、2mol H2(g)、2molCO(g),则起始时v (正)______v (逆) (填“>”、“<”或“=”)。
(3)纳米铁粉与水中NO3-反应的离子方程式为 4Fe+ NO3-+10H+=4Fe2++NH4++3H2O
①研究发现,若pH偏低将会导致NO3-的去除率下降,其原因是_________________。
②相同条件下,纳米铁粉去除不同水样中NO3-的速率有较大差异,图2中所产生的差异的可能原因是__________________________________________________(答一条)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com