
| 族 周期 |
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 1 | ① | ||||||
| 2 | ② | ③ | ④ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ||
 ,故答案为:
,故答案为: ;
;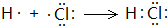 ,
,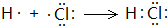 ;
;
| ||
| ||
| 浓硫酸 |
| △ |
| 浓硫酸 |
| △ |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
 向含有Fe2+、I-、Br-的溶液中通入适量氯气,溶液中各种离子的物质的量变化如下图所示.有关说法不正确的是( )
向含有Fe2+、I-、Br-的溶液中通入适量氯气,溶液中各种离子的物质的量变化如下图所示.有关说法不正确的是( )| A、还原性I->Fe2+>Br- |
| B、原混合溶液中n(FeBr2)=4mol |
| C、当通入Cl2 2mol时,溶液中发生的离子反应可表示为:2Fe2++2I-+2Cl2═2Fe3++I2+4Cl- |
| D、原溶液中n(Fe2+):n(I-):n(Br-)=2:1:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 过氧化银(Ag2O2)是银锌碱性电池正极的活性物质,可通过下列反应制备:
过氧化银(Ag2O2)是银锌碱性电池正极的活性物质,可通过下列反应制备:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 3 |
| 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、K+、Cu2+、NO3-、SO32- |
| B、K+、Na+、Cl-、SiO32- |
| C、Al3+、NH4+、NO3-、Cl- |
| D、K+、Na+、AlO2-、Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com