
【题目】在一固定容积的密闭容器中,置入一定量的一氧化氮和足量碳发生化学反应:C(s)+2NO(g)![]() CO2(g)+N2(g),平衡时c(NO)与温度T的关系如图所示,则下列说法正确的是( )
CO2(g)+N2(g),平衡时c(NO)与温度T的关系如图所示,则下列说法正确的是( )

A.在T2时,若反应体系处于状态D,则此时v(正)<v(逆)
B.若该反应在T1、T2时的平衡常数分别为K1、K2,则K1<K2
C.若状态B、C、D的压强分别为PB、PC、PD,则PC>PD=PB
D.该反应的△H>0
【答案】C
【解析】
A选项,在T2时,若反应体系处于状态D,D处一氧化氮的浓度要 B点,说明要消耗一氧化氮,平衡正向移动,即v(正) > v(逆),故A错误;
B选项,若该反应在T1、T2时的平衡常数分别为K1、K2,从T1到T2,温度升高,一氧化氮浓度增加,说明逆向移动,K减小,故B错误;
C选项,由于该反应是等体积反应,B、C、D三处的气体物质的量相等,但由于C处温度高,因此气体压强大,因此压强大小分别为PC>PD=PB,故C正确;
D选项,从T1到T2,温度升高,一氧化氮浓度增加,说明逆向移动,升温向吸热方向移动,即逆向是吸热反应,正向放热反应,故D错误;
综上所述,答案为C。


科目:高中化学 来源: 题型:
【题目】乙二酸(H2C2O4)是一种重要的化工产品。其制备工艺流程如下:
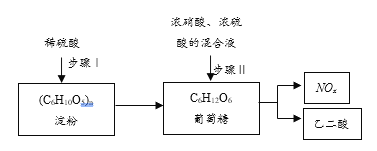
步骤Ⅱ中葡萄糖(结构简式: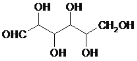 )被氧化成乙二酸,需控制反应温度为55~60℃,边搅拌边滴加浓硝酸、浓硫酸的混合液,可发生下列反应:
)被氧化成乙二酸,需控制反应温度为55~60℃,边搅拌边滴加浓硝酸、浓硫酸的混合液,可发生下列反应:
C6H12O6+18HNO3→3H2C2O4+18NO2↑+12H2O
C6H12O6+6HNO3→3H2C2O4+6NO↑+6H2O
(1)步骤Ⅰ中淀粉水解成葡萄糖,使用______试剂可检验淀粉是否完全水解。
(2)步骤Ⅱ的氧化过程需控制反应温度为55~60℃的原因:①温度过低,则_______________;②温度过高,则_________________。
(3)检验氧化后的溶液中是否仍含有葡萄糖的实验方案是_______________。
(4)H2C2O4能使酸性KMnO4溶液褪色,配平离子方程式并标出电子转移的方向和数目。____H2C2O4+____MnO4-+____H+→____CO2↑+____Mn2++____H2O,______________
(5)若尾气NOx中,n(NO2):n(NO)=1:2,则每生产6.3kg乙二酸会产生标准状况下_____________L的NO2。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有200 mL MgCl2和AlCl3混合溶液,其中Mg2+浓度0.2mol/L、 Cl-浓度为1.3 mol/L。要使Mg2+转化成Mg(OH)2并使Mg2+、Al3+分离开来,至少需要4 mol/L NaOH溶液( )
A. 80mLB. 100mLC. 120mLD. 140mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式正确的是( )
A.甲烷的燃烧热为890.3kJ/mol,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)![]() CO2(g)+2H2O(g) ΔH=-890.3kJ/mol
CO2(g)+2H2O(g) ΔH=-890.3kJ/mol
B.在200℃、101KPa时,H2与碘蒸气作用生成1 mol HI放出热量7.45kJ,其热化学方程式为I2(g)+H2(g)=2HI(g) ΔH=-14.9kJ/mol
C.已知在101kPa下,1gH2燃烧生成水蒸气放出121kJ热量,其热化学方程式为H2(g)+![]() O2(g)=H2O(g) ΔH=-242kJ/mol
O2(g)=H2O(g) ΔH=-242kJ/mol
D.25℃,101kPa时,强酸与强碱的稀溶液发生中和反应的中和热为57.3kJ/mol,表示硫酸溶液与氢氧化钾溶液反应的中和热的热化学方程式为H2SO4(aq)+2KOH(aq)=K2SO4(aq)+2H2O(l) ΔH=-114.6kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是部分短周期元素原子半径与原子序数的关系,则下列说法正确的是
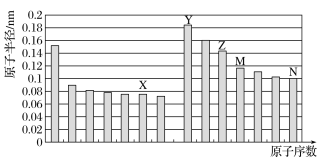
A.M在周期表中的位置为:第三周期,IV族
B.Y和N形成的化合物为离子化合物
C.X、N两种元素的气态氢化物的沸点相比,前者较低
D.Y元素和X元素可以形成Y2X2型化合物,阴、阳离子物质的量之比为1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】启普发生器是荷兰科学家设计的实验室气体发生装置,由图中漏斗1和容器2两部分构成;现借助启普发生器及相关装置模拟侯氏制碱法制备日用化学品——NH4Cl和Na2CO3。回答相关问题:
(NaHCO3的制备)
反应原理:NH3+NaCl+CO2+H2O=NH4Cl+NaHCO3↓
反应装置:

(1)启普发生器中发生的离子反应方程式为___,如果上述装置中导管被堵塞,启普发生器中观察到的现象是___。
(2)仪器3中盛装的试剂是___;已知常温,NaCl的溶解度为35.9g,仪器4中含氨的饱和食盐水的配制方法是将20.0mL浓氨水与8.0gNaCl混合振荡过滤,试推测过滤除去的物质为___。
(3)观察仪器4中CO2流速的方法是___,仪器5中试剂的作用是___。
(4)反应结束后,对仪器4进行冷却并趁冷过滤其中的悬浊液,“趁冷”的目的是___。
(Na2CO3的制备)
(5)将(4)所得固体转移至蒸发皿中加热得到Na2CO3;请设计简单实验证明NaHCO3固体已分解完全___。
(NH4Cl的制备)
(6)向(4)所得母液中加入两种物质并降温,NH4Cl会逐步结晶析出,所加物质的名称是___,过滤NH4Cl晶体后的滤液可以再次循环使用。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】羰基硫(COS)可作为一种粮食熏蒸剂,能防止某些昆虫、线虫和真菌的危害。在2L恒容密闭容器中,将CO和H2S混合加热并达到下列平衡:CO(g)+H2S(g)![]() COS(g)+H2(g) K=0.1,反应前CO物质的量为10mol,2min达到平衡后CO物质的量为8mol。下列说法正确的是( )
COS(g)+H2(g) K=0.1,反应前CO物质的量为10mol,2min达到平衡后CO物质的量为8mol。下列说法正确的是( )
A.升高温度,H2S浓度增加,表明该反应是吸热反应
B.通入CO后,正反应速率逐渐增大
C.反应前H2S物质的量为7mol
D.CO的平均反应速率为0.5mol/(L·s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g)![]() 2NO2(g),随温度升高,混合气体的颜色变深。
2NO2(g),随温度升高,混合气体的颜色变深。
回答下列问题:
(1)反应的ΔH__0(填“大于”或“小于”);100℃时,体系中各物质浓度随时间变化如图所示。在0~60s时段,反应速率v(N2O4)为___mol/(L·s);反应的平衡常数K1为_____。

(2)100℃时达到平衡后,改变反应温度为T,N2O4以平均速率0.002 0mol/(L·s)降低,经10s又达到平衡。
①T___100℃(填“大于”或“小于”)
②计算温度T时反应的平衡常数K2为_____。
(3)温度T时反应达平衡后,将反应容器的容积增大一倍。平衡向___(填“正反应”或“逆反应”)方向移动,判断理由是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】香兰素是重要的香料之一,它可由丁香酚经多步反应合成。
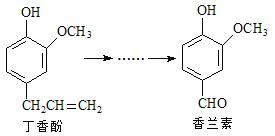
有关上述两种化合物的说法正确的是
A. 常温下,1mol丁香酚只能与1molBr2反应
B. 丁香酚不能使FeCl3溶液发生显色反应
C. 1mol香兰素最多能与3mol氢气发生加成反应
D. 香兰素分子中至少有12个原子共平面
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com