
【题目】启普发生器是荷兰科学家设计的实验室气体发生装置,由图中漏斗1和容器2两部分构成;现借助启普发生器及相关装置模拟侯氏制碱法制备日用化学品——NH4Cl和Na2CO3。回答相关问题:
(NaHCO3的制备)
反应原理:NH3+NaCl+CO2+H2O=NH4Cl+NaHCO3↓
反应装置:

(1)启普发生器中发生的离子反应方程式为___,如果上述装置中导管被堵塞,启普发生器中观察到的现象是___。
(2)仪器3中盛装的试剂是___;已知常温,NaCl的溶解度为35.9g,仪器4中含氨的饱和食盐水的配制方法是将20.0mL浓氨水与8.0gNaCl混合振荡过滤,试推测过滤除去的物质为___。
(3)观察仪器4中CO2流速的方法是___,仪器5中试剂的作用是___。
(4)反应结束后,对仪器4进行冷却并趁冷过滤其中的悬浊液,“趁冷”的目的是___。
(Na2CO3的制备)
(5)将(4)所得固体转移至蒸发皿中加热得到Na2CO3;请设计简单实验证明NaHCO3固体已分解完全___。
(NH4Cl的制备)
(6)向(4)所得母液中加入两种物质并降温,NH4Cl会逐步结晶析出,所加物质的名称是___,过滤NH4Cl晶体后的滤液可以再次循环使用。
【答案】CaCO3+2H+=Ca2++H2O+CO2↑ 漏斗l中酸液面升高,容器2中酸液而下降 饱和NaHCO3 NaCl 观察仪器4中导管口逸出气泡的快慢 吸收NH3 减小NaHCO3溶解度以提高产率 用一干冷玻璃片靠近蒸发皿上方,如果玻璃片上没有水珠则NaHCO3分解完全 氨气和氯化钠
【解析】
利用启普发生器制取CO2,制得的CO2中含有HCl等杂质,利用饱和NaHCO3溶液除去CO2中的HCl,CO2再通入含氨的饱和食盐水中,氨气可能会逸出,利用稀硫酸吸收氨气。
(1)启普发生器中要产生CO2,通过碳酸钙和盐酸反应生成,则离子反应方程式为CaCO3+2H+=Ca2++H2O+CO2↑,如果上述装置中导管被堵塞,则启普发生器中气体压强增大,则漏斗l中酸液面升高,容器2中酸液而下降;
(2)仪器3用于除去CO2气体中的HCl气体,则需用饱和NaHCO3;20.0mL浓氨水与8.0gNaCl混合配制溶液,已知NaCl的溶解度为35.9g,则假设20.0mL浓氨水近似20水,能溶解的氯化钠约7.2g,故混合液中未溶解的是NaCl,故过滤除去的物质为NaCl;
(3)CO2从液体中逸出时会产生气泡,故观察仪器4中CO2流速的方法是观察仪器4中导管口逸出气泡的快慢,仪器5位于整套装置的末尾,主要用于尾气处理,其中的硫酸会吸收NH3;
(4)本实验目的是制备NaHCO3,它是可溶性固体,故减少NaHCO3在水中溶解的量能提高产量,因此“趁冷”过滤的目的是减小NaHCO3溶解度以提高产率;
(5)碳酸氢钠固体分解时有水蒸气产生,故要设计简单实验证明NaHCO3固体已分解完全,可用一干冷玻璃片靠近蒸发皿上方,如果玻璃片上没有水珠则NaHCO3分解完全;
(6)过滤出碳酸氢钠所得母液中含Na+、HCO3-、Cl-和NH4+,假如想提取NH4Cl,则需增大Cl-和NH4+的浓度,故可通入NH3和加入NaCl,NH3·H2O和HCO3-反应,则Cl-和NH4+的浓度增大,经降温,会逐步结晶析出NH4Cl。


科目:高中化学 来源: 题型:
【题目】如图是部分短周期元素的单质及其化合物(或其溶液)的转化关系。已知在常温常压下,A是固体,B、C、D、E是非金属单质且都是气体,C呈黄绿色;化合物F是淡黄色固体,化合物G的焰色反应为黄色,化合物Ⅰ和J通常状况下呈气态;D和E反应生成一种刺激性气味的气体。
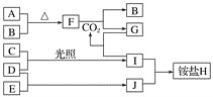
请回答下列问题:
(1)E和J的化学式分别是________和________。
(2)写出F和CO2反应的化学方程式并用单线桥法表示电子转移的情况:_________。
(3)将少量单质C通入盛有淀粉碘化钾溶液的试管中,溶液变蓝色,该反应的离子方程式为_________。
(4)标况下3.36 L气体B与A完全反应,转移电子的数目为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图实验装置用于验证某些物质的性质。在试管A中装入足量的固体NaHCO3。试回答下列问题:

(1)在A试管内发生反应的化学方程式是___________________。
(2)B装置的作用是_____________________。
(3)在双球干燥管内发生反应的化学方程式为______________________。
(4)双球干燥管内观察到的实验现象是____________________________。
上述实验现象说明____________________________。
(5)若将干燥管内的Na2O2换成Na2O,则双球干燥管内观察到的实验现象是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向10.00mL浓度均为0.100molL-1的NaOH溶液和二甲胺[(CH3)2NHH2O]的混合溶液中逐滴加入盐酸。利用传感器测得该过程溶液中的阳离子总浓度变化曲线如图;巳知二甲胺在水中电离与氨相似,常温下Kb[(CH3)2NHH2O]=l.60×l0-4。下列说法正确的是( )
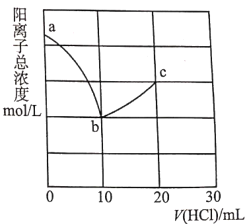
A.a点溶液中,c[(CH3)2NH2+]约为l.60×l0-4mol/L
B.从a到c的过程中,水的电离程度最大的是b点
C.c点溶液中:3c(Na+)+c[(CH3)2NH2+]=2c(Cl-)
D.V(HCl)=15.00mL时,c[(CH3)2NH2+]<c[(CH3)2NHH2O]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一固定容积的密闭容器中,置入一定量的一氧化氮和足量碳发生化学反应:C(s)+2NO(g)![]() CO2(g)+N2(g),平衡时c(NO)与温度T的关系如图所示,则下列说法正确的是( )
CO2(g)+N2(g),平衡时c(NO)与温度T的关系如图所示,则下列说法正确的是( )

A.在T2时,若反应体系处于状态D,则此时v(正)<v(逆)
B.若该反应在T1、T2时的平衡常数分别为K1、K2,则K1<K2
C.若状态B、C、D的压强分别为PB、PC、PD,则PC>PD=PB
D.该反应的△H>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示中,A为一种常见的单质,B、C、D、E是含A元素的常见化合物,它们的焰色实验均为黄色。
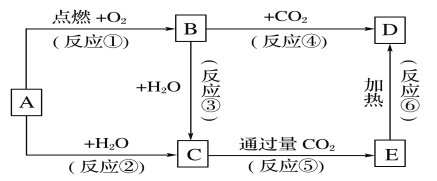
请填写下列空白:
(1)写出下列化学式:A____________,D____________
(2)以上反应中,不属于氧化还原反应的有________________(填序号)。
(3)完成方程式
①A→C反应的离子方程式:______________________________________________,
②B→D反应的化学方程式:______________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气中NO产生的反应为:N2(g)+O2(g)![]() 2NO(g),一定条件下,等物质的量的N2(g)和O2(g)在恒容密闭容器中反应,如图曲线a表示该反应在温度T下N2的浓度随时间的变化,曲线b表示该反应在某一起始反应条件改变时N2的浓度随时间的变化。下列叙述不正确的是( )
2NO(g),一定条件下,等物质的量的N2(g)和O2(g)在恒容密闭容器中反应,如图曲线a表示该反应在温度T下N2的浓度随时间的变化,曲线b表示该反应在某一起始反应条件改变时N2的浓度随时间的变化。下列叙述不正确的是( )
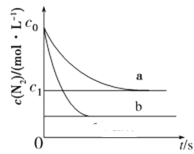
A.温度T下,该反应的平衡常数![]()
B.温度T下,随着反应的进行,混合气体的密度不变
C.曲线b对应的条件改变可能是增大压强
D.若曲线b对应的条件改变是温度,可判断该反应的ΔH>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)有一瓶无色澄清溶液,其中可能含H+、Na+、Mg2+、NH4+、Ba2+、Cl、SO42-、CO32-离子。现进行以下实验:
A.用pH试纸检验溶液,发现溶液呈强酸性;
B.取部分溶液逐滴加入浓NaOH溶液,使溶液由酸性变为碱性,无沉淀产生,产生了能使湿润的红色石蕊试纸变蓝的气体;
C.取少量B中的碱性溶液,滴加Na2CO3溶液,有白色沉淀产生。
①根据上述事实确定:该溶液中肯定存在的离子有__;肯定不存在的离子有__。
②写出B中发生反应的离子方程式__。
(2)某化学学习小组模拟侯德榜制碱法制取Na2CO3的过程如下:
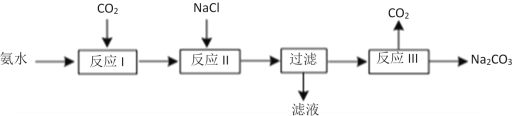
已知:a.反应Ⅰ的化学方程式为:NH3+H2O+CO2=NH4HCO3
b.滤液含NH4Cl等溶质
①反应Ⅱ为复分解反应,写出该反应的化学方程式___。
②验证滤液中含Cl-离子的实验方法和现象为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与我们的生活密切相关,请回答:
(1)在生活中要注意饮食平衡,蛋白质属于_______(填序号,下同)食物,番茄属于______食物;①酸性 ②碱性
(2)有四种常见药物①阿司匹林、②青霉素、③胃舒平、④麻黄碱. 某同学胃酸过多,应该服用______(填序号,下同);从用药安全角度考虑,使用前要进行皮肤敏感性测试的是_____;由于具有兴奋作用,国际奥委会严禁运动员服用的是_________;
(3)苹果汁是人们喜爱的饮品,由于其中含有Fe2+,现榨的苹果汁在空气中会由浅绿色变为棕黄色,若榨汁时加入维生素C,可有效防止这种现象发生.这说明维生素C具有________(填序号);①氧化性 ②还原性 ③碱性 ④酸性
(4)食用植物油进入人体后,在酶的作用下水解为高级脂肪酸和_________(写名称),进而被氧化成二氧化碳和水并提供能量,或作为合成人体所需其他物质的原料;
(5)硫酸亚铁可用于治疗缺铁性贫血,某贫血患者每天须补充1.4g铁元素,则服用的药物中含硫酸亚铁的质量至少为_________g;
(6)氨基酸是组成蛋白质的基本结构单元,其分子中一定含有的官能团是氨基(﹣NH2)和____(写结构简式或名称).人体中共有二十多种氨基酸,其中人体自身________(填“能”或“不能”)合成的氨基酸称为人体必需氨基酸;
(7)淀粉在淀粉酶的作用下最终水解为葡萄糖(C6H12O6),部分葡萄糖在体内被氧化生成二氧化碳和水.写出葡萄糖在体内被氧化的化学方程式:________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com